К 250 г известковой воды прилили избыток раствора натрий карбоната.При этом выпал осадок массой 0,5 г.Какова массовая доля Ca(OH)2 в известковой воде?
Ответы
Ответ дал:
0
Ответа случайно нет?
Приложения:
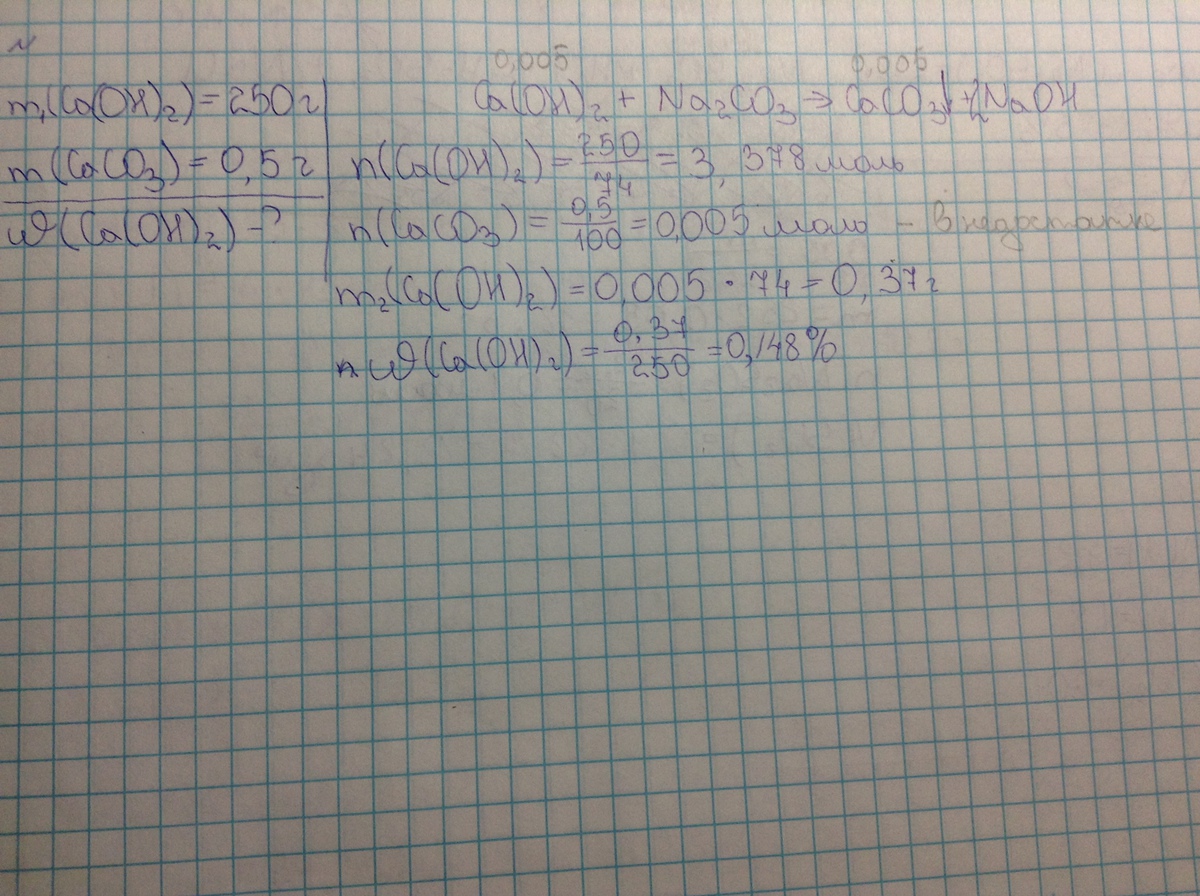
Ответ дал:
0
http://znanija.com/task/15370497 - ПОМОГИ ПЛЗ
Ответ дал:
0
оТВЕТ ЕСЛИ ОКРУГЛИТЬ,НЕ БУДЕТ 0,14
Ответ дал:
0
А ты не округляй, ответ 0,14 будет это точно!!!!
Ответ дал:
0
n Ca(OH)2 = n CaCO3 = 0.5/100 = 0.005 моль;
Ответ дал:
0
м.д. Ca(OH)2 = ((74*0.005)/250)*100 = 0.148% (наиболее близкий вар-т - Г).
Ответ дал:
0
Ca(OH)₂ + Na₂CO₃ = CaCO₃ + 2NaOH
n(Ca(OH)₂=m/M=250/74=3,4 моль - всего
n(CaCO₃)=m/M=0,5/100=0,005 моль=n(Ca(OH)₂), вступившего в реакцию
m(Ca(OH)₂=0,005*74=0,37 г
w(Ca(OH)₂)=0,37/250*100=0,148%
ОТВЕТ: 0,148%
n(Ca(OH)₂=m/M=250/74=3,4 моль - всего
n(CaCO₃)=m/M=0,5/100=0,005 моль=n(Ca(OH)₂), вступившего в реакцию
m(Ca(OH)₂=0,005*74=0,37 г
w(Ca(OH)₂)=0,37/250*100=0,148%
ОТВЕТ: 0,148%
Приложения:
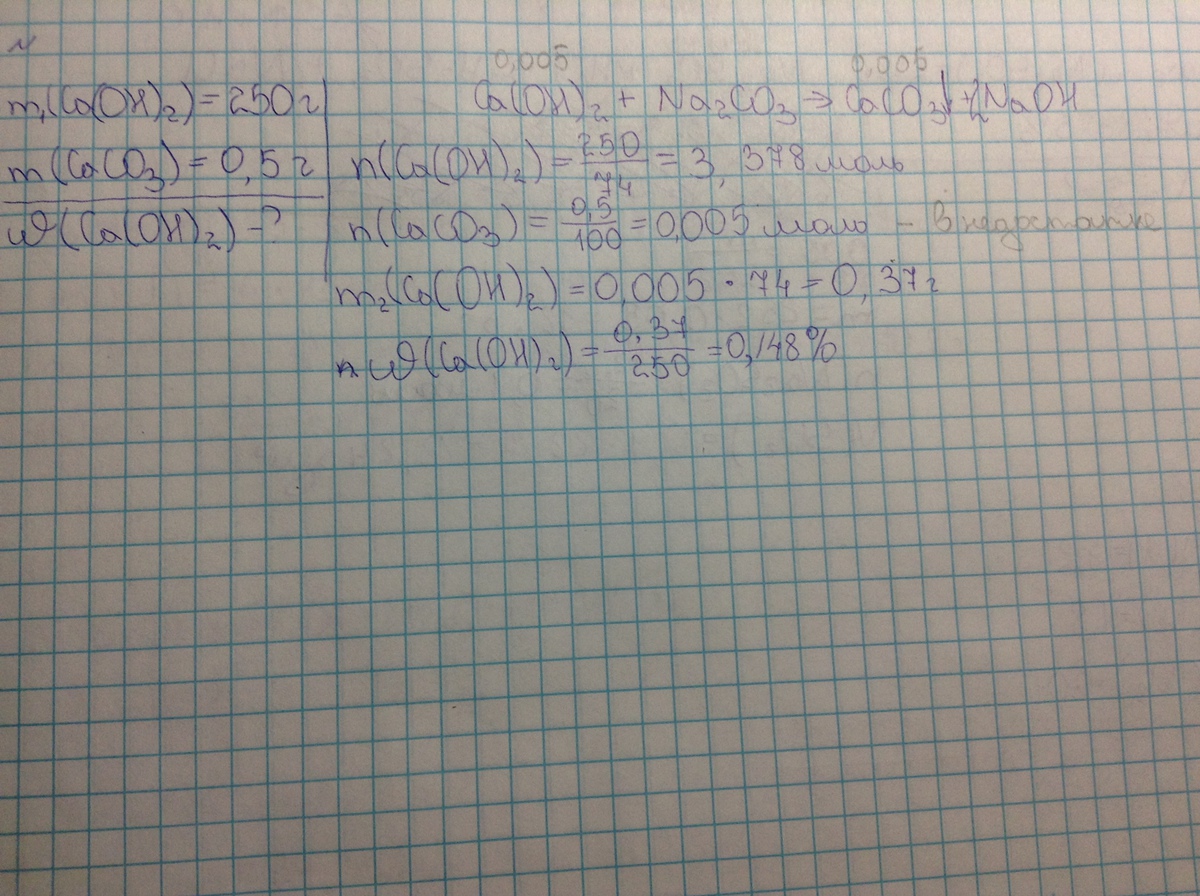
Ответ дал:
0
http://znanija.com/task/15370497 - ПОМОГИ ПЛЗ
Ответ дал:
0
ТЕ КТО МНЕ ТАМ НАПИСАЛ ЭТО НЕПРАВИЛЬНО,ВСЯ НАДЕЖДА НА ТЕБЯ
Вас заинтересует
2 года назад
7 лет назад
7 лет назад
10 лет назад
10 лет назад
10 лет назад