Какой объём метана сожгли, если добытый углекислый газ пропустили через избыток раствора натрия гидроксида и добыли 212г соли?
Ответы
Ответ дал:
0
Для начала реакции:
1) СН4 + 2*О2 = СО2 + 2*Н2О
2) СО2 + 2*NaOH = Na2CO3 + H2O
Масса карбоната = 212
Его молярная масса = 23+23+12+16+16+16 = 106
Количества вещества (ню) = масса/молярная масса = 212/106 = 2 моль
Ню метана по реакциям будет равно ню того самого карбоната и будет равно 2 моль
Объем = ню * молярный объем = 2 *22,4 = 44,8 л
1) СН4 + 2*О2 = СО2 + 2*Н2О
2) СО2 + 2*NaOH = Na2CO3 + H2O
Масса карбоната = 212
Его молярная масса = 23+23+12+16+16+16 = 106
Количества вещества (ню) = масса/молярная масса = 212/106 = 2 моль
Ню метана по реакциям будет равно ню того самого карбоната и будет равно 2 моль
Объем = ню * молярный объем = 2 *22,4 = 44,8 л
Ответ дал:
0
Можно решить более подробно, если нужно
Приложения:

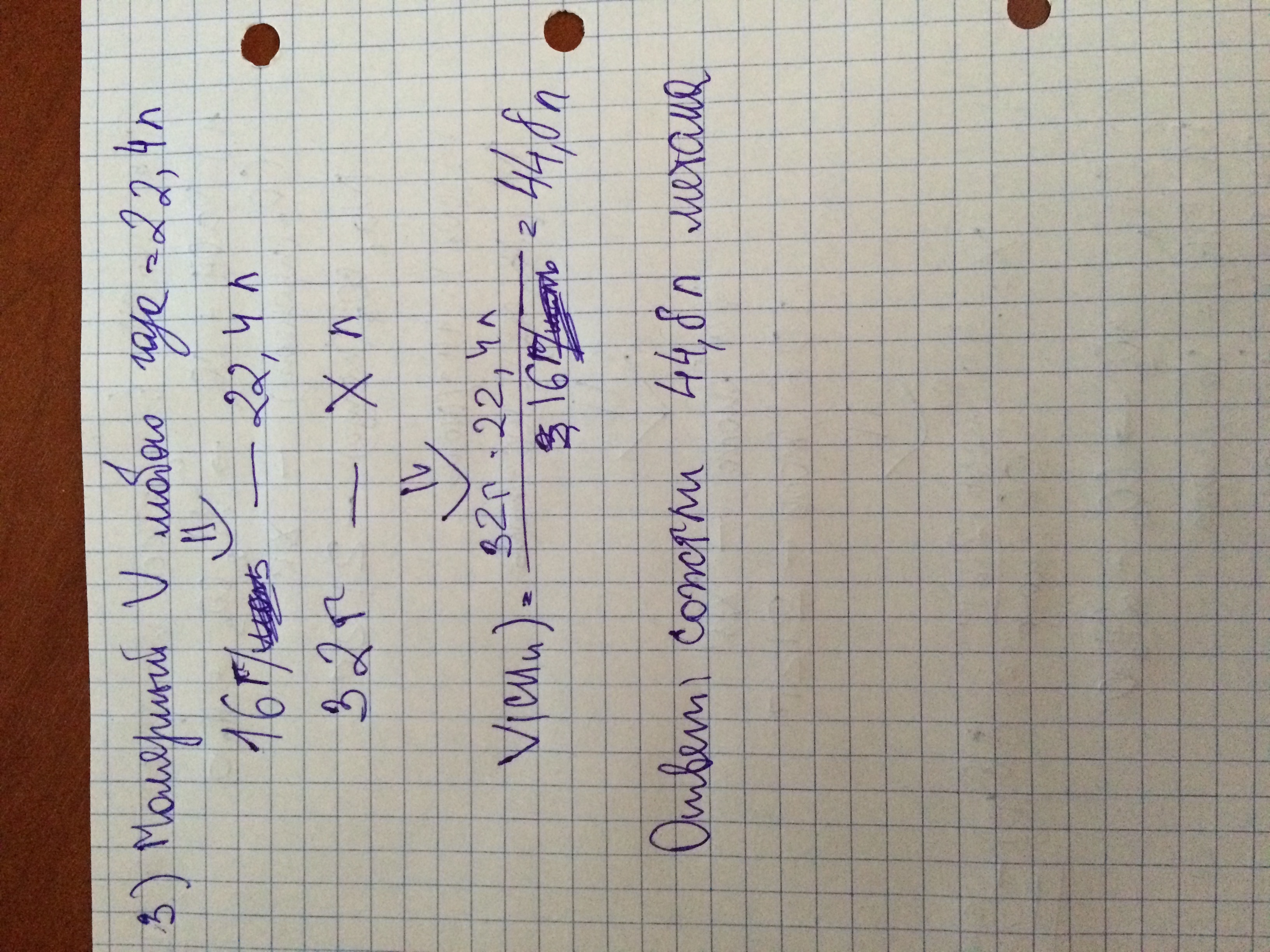
Ответ дал:
0
если несложно то решите более подробней
Ответ дал:
0
Это и есть подробное решение.
Ответ дал:
0
Тогда спасибо)
Вас заинтересует
2 года назад
7 лет назад
10 лет назад