Сколько (г) осадка получится при реакции 50(г) р-ра сульфата алюминия w=34,2% с раствором гидроксида натрия массой 50г w=20%
Ответы
Ответ дал:
0
qqqqqqqqqqqqqqqqqqqqqqqqqqqqqqqqq
Приложения:
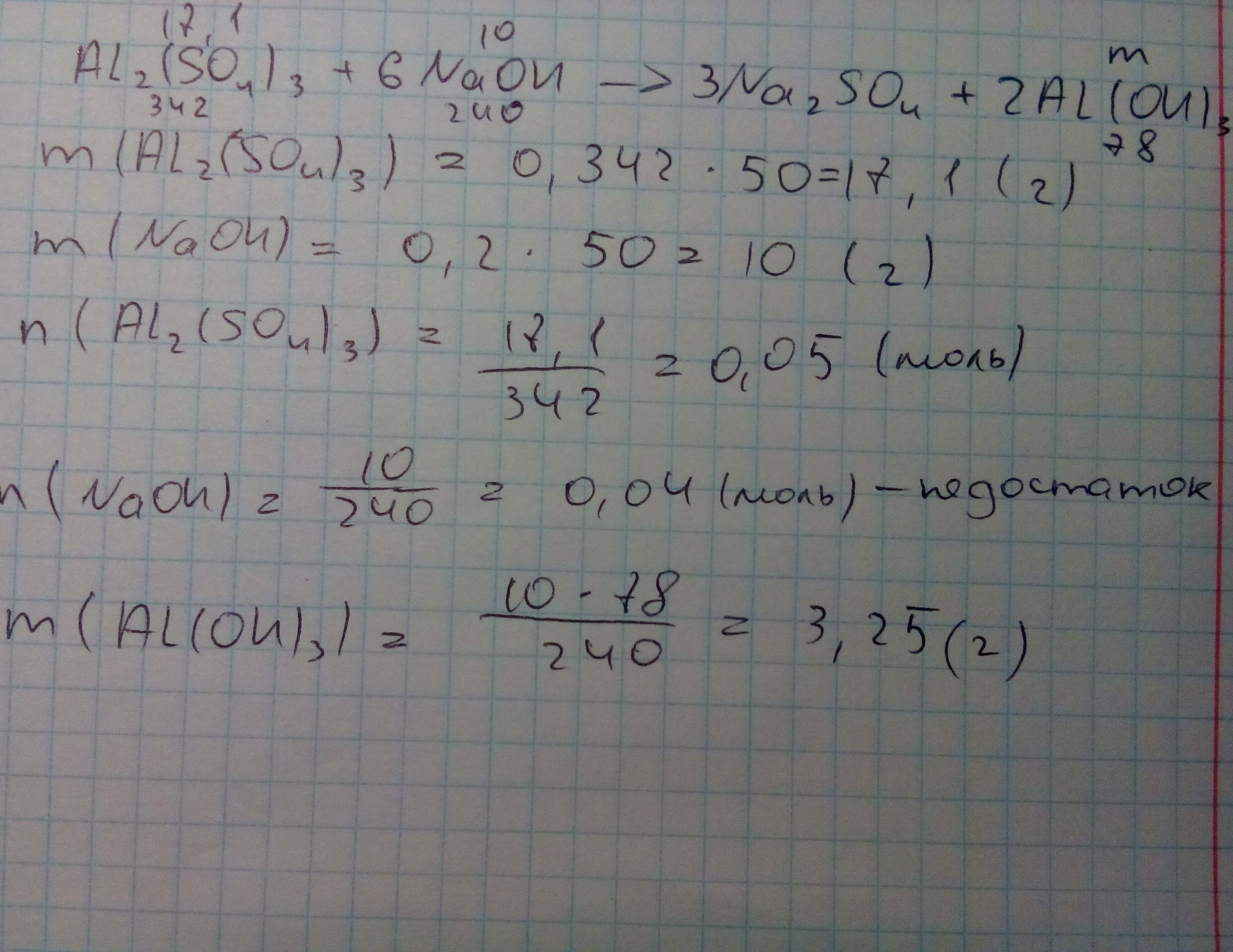
Ответ дал:
0
1) находим массу вещества сульфата алюминия
m(Al2(SO4)3)=50*34.2%/100%=17.1 g
2)Находим массу вещества гидроксида натрия
m(NaOH)=50*20%/100%=10 g
17.1 10 x g
Al2(SO4)3+6NaOH-->3Na2SO4+2Al(OH)3↓
342 2*78
M(Al2(SO4)3)=342 g/mol
M(NaOH)=40 g/mol
M(Al(OH)3)=78 g/mol
n(AL2(SO4)3)=m/M=17.1/342=0.05 mol
n(NaOH)=m/M=10/40=0.25 mol
n(AL2(SO4)3)<n(NaOH)
17.1 / 342 = X/156
X=7.8 g
ответ 7.8 г
m(Al2(SO4)3)=50*34.2%/100%=17.1 g
2)Находим массу вещества гидроксида натрия
m(NaOH)=50*20%/100%=10 g
17.1 10 x g
Al2(SO4)3+6NaOH-->3Na2SO4+2Al(OH)3↓
342 2*78
M(Al2(SO4)3)=342 g/mol
M(NaOH)=40 g/mol
M(Al(OH)3)=78 g/mol
n(AL2(SO4)3)=m/M=17.1/342=0.05 mol
n(NaOH)=m/M=10/40=0.25 mol
n(AL2(SO4)3)<n(NaOH)
17.1 / 342 = X/156
X=7.8 g
ответ 7.8 г
Приложения:
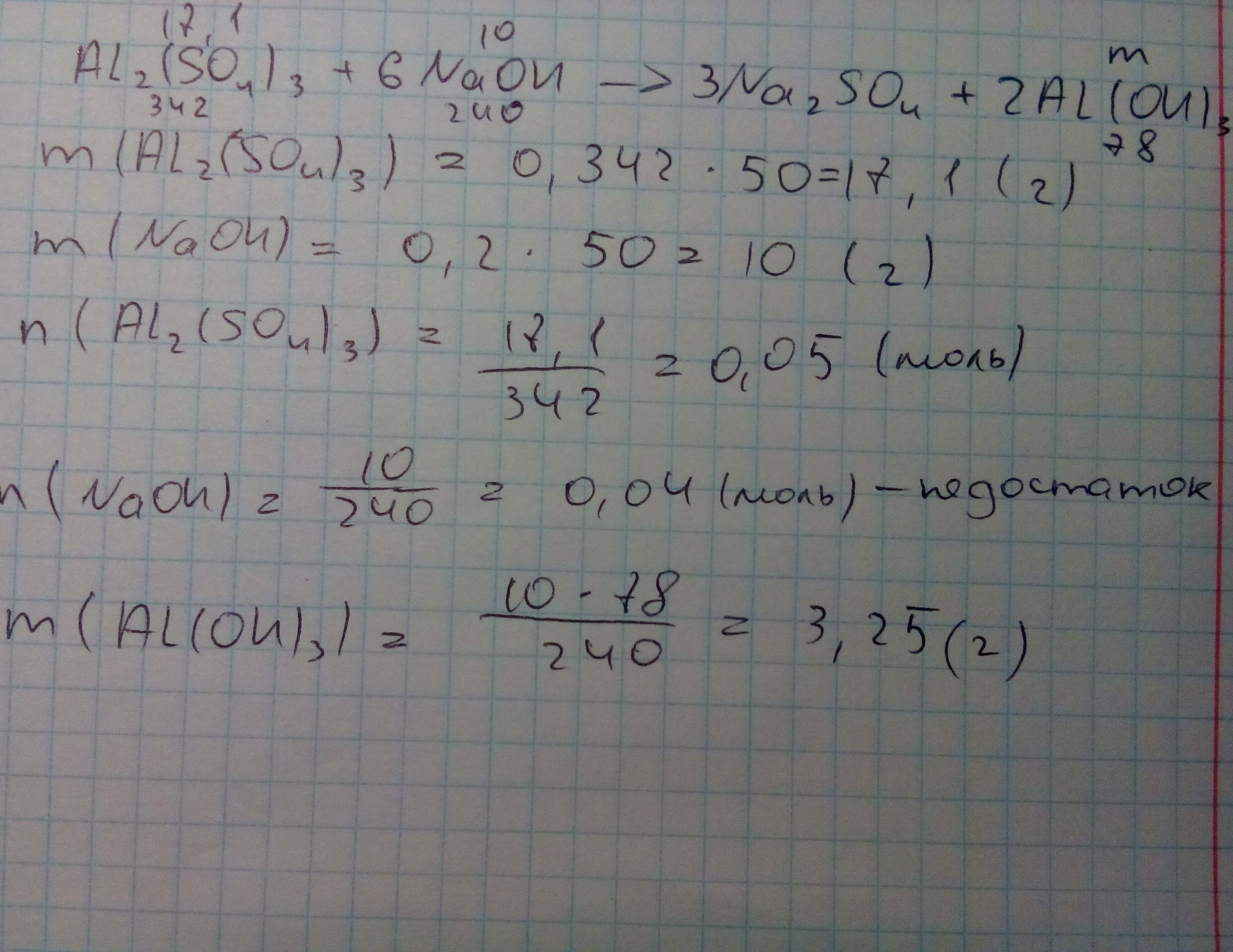
Вас заинтересует
2 года назад
2 года назад
7 лет назад
9 лет назад
9 лет назад
10 лет назад