Ответы
Ответ дал:
0
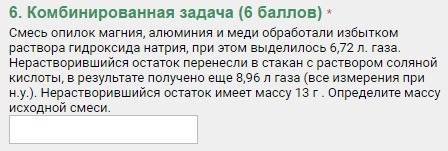
Дано:
V'(H2) = 6,72 л
V"(H2) = 8,96 л
m(осадка) = 13 г
Найти:
m(Al)=?
m(Mg)=?
m(Cu)=?
Решение.
С гидроксидом натрия реагирует лишь алюминий, с выделением газа с соляной кислотой будет реагировать магний, медь не реагирует ни с гидроксидом натрия, ни с соляной кислотой, поэтому оставшийся осадок будет массой меди. Составляем уравнения реакций и находим массы алюминия и магния.
х г 6,72 л
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
54 г (27 г/моль*2 моль) 67,2 л (22,4 л/моль*3 моль)
х=m(Al) = 5.4 г
x' г 8,96 л
Mg + 2HCl = MgCl2 + H2
24 г 22,4 л
x'=m(Mg) = 9,6 г
m(Cu) = 13 г
Ответ: 5,4 г алюминия, 9,6 г магния и 13 г меди
V'(H2) = 6,72 л
V"(H2) = 8,96 л
m(осадка) = 13 г
Найти:
m(Al)=?
m(Mg)=?
m(Cu)=?
Решение.
С гидроксидом натрия реагирует лишь алюминий, с выделением газа с соляной кислотой будет реагировать магний, медь не реагирует ни с гидроксидом натрия, ни с соляной кислотой, поэтому оставшийся осадок будет массой меди. Составляем уравнения реакций и находим массы алюминия и магния.
х г 6,72 л
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
54 г (27 г/моль*2 моль) 67,2 л (22,4 л/моль*3 моль)
х=m(Al) = 5.4 г
x' г 8,96 л
Mg + 2HCl = MgCl2 + H2
24 г 22,4 л
x'=m(Mg) = 9,6 г
m(Cu) = 13 г
Ответ: 5,4 г алюминия, 9,6 г магния и 13 г меди
Вас заинтересует
7 лет назад
7 лет назад
10 лет назад