Помогите решить задачу по химии,пожалуйста!
Какой объем раствора натрий гидроксида с массовой долей щелочи 14% (плотность=1,116 г/моль) нужен для нейтрализации одноосновной карбоновой кислоты массой 40 г. Массовые доли Карбона,Оксигена и Гидрогена в кислоте составляет соответственно 26,09%, 69,57%, 4,34%
Ответы
Ответ дал:
0
Надеюсь понятно &&&&____&&&&
Приложения:
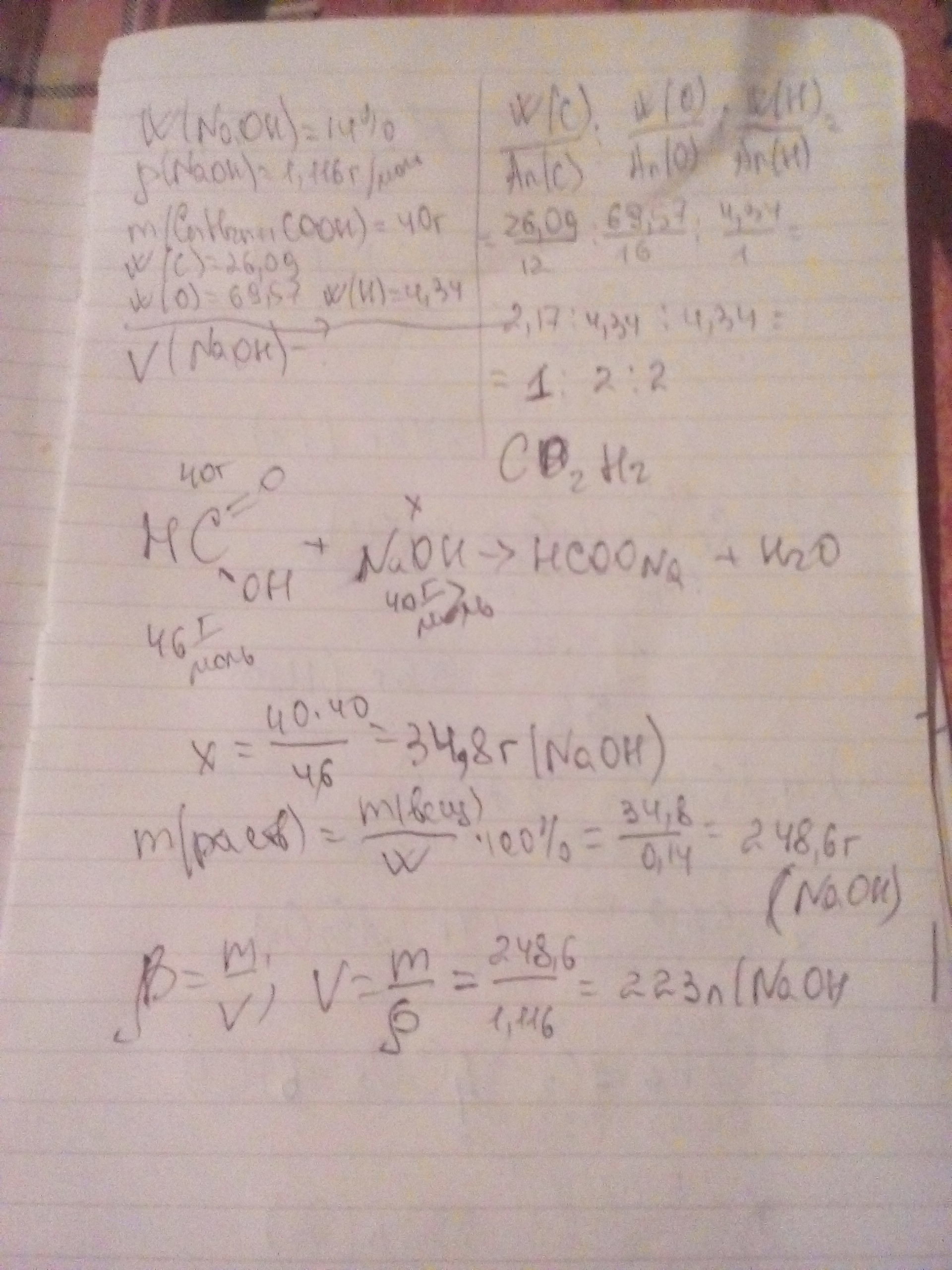
Ответ дал:
0
находим молекулярную формулу одноосновной к-ты
CxHyOz= 26.09/12 :4.34/1:69.57/16
CxHyOz=2 : 4 : 4
CxHyOz=1:2:2
CH2O2
==> HCOOH
по УХР находим массу вещества NaOH
40 Xg
HCOOH+NaOH-->HCOONa+H2O
46 40
M(HCOOH)=46 g/mol , M(NaOH)=40 g/mol
40/46 = X/40
X=34.78 g
m(ppaNaOH)=34.78*100%/14%=248.43 g
V(ppaNaOH)=m/p=248.43 / 1.116=222.6 мл
ответ 222.6 мл
CxHyOz= 26.09/12 :4.34/1:69.57/16
CxHyOz=2 : 4 : 4
CxHyOz=1:2:2
CH2O2
==> HCOOH
по УХР находим массу вещества NaOH
40 Xg
HCOOH+NaOH-->HCOONa+H2O
46 40
M(HCOOH)=46 g/mol , M(NaOH)=40 g/mol
40/46 = X/40
X=34.78 g
m(ppaNaOH)=34.78*100%/14%=248.43 g
V(ppaNaOH)=m/p=248.43 / 1.116=222.6 мл
ответ 222.6 мл
Приложения:
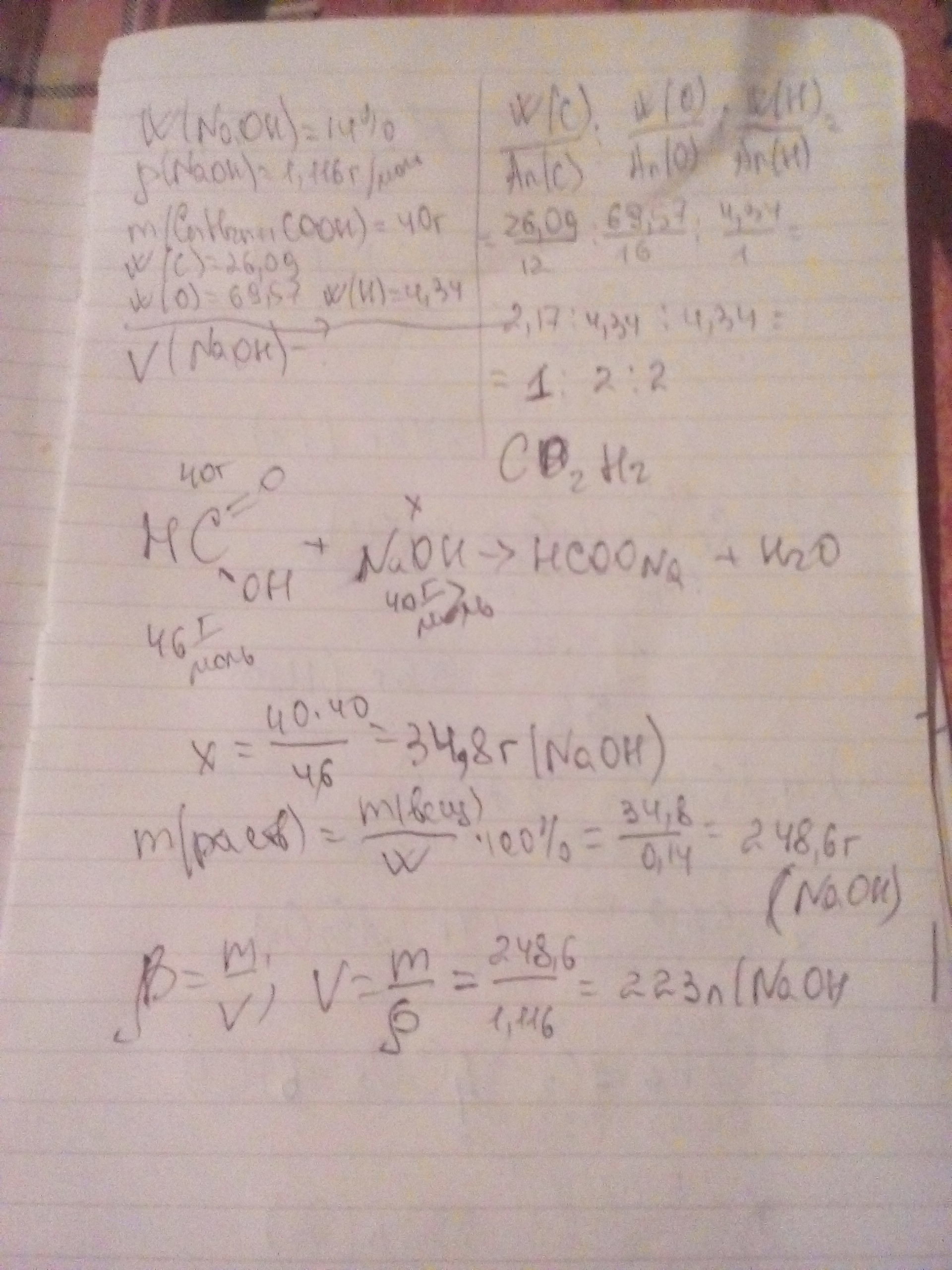
Вас заинтересует
2 года назад
2 года назад
7 лет назад
7 лет назад
9 лет назад
10 лет назад