Ответы
Ответ дал:
0
pH = - lg[H⁺]
Поскольку серная кислота - сильная, то она практически полностью диссоциирует на ионы:
H₂SO₄ = 2 H⁺ + SO₄²⁻
Как видно из уравнения, концентрация ионов H⁺ в два раза выше концентрации кислоты, взятой для растворения:
[H⁺] = 2*С(H₂SO₄) = 2* 0,1 = 0,2 М
pH = - lg[H⁺] = - lg0.2 = 0.7
Ответ: pH = 0,7
Поскольку серная кислота - сильная, то она практически полностью диссоциирует на ионы:
H₂SO₄ = 2 H⁺ + SO₄²⁻
Как видно из уравнения, концентрация ионов H⁺ в два раза выше концентрации кислоты, взятой для растворения:
[H⁺] = 2*С(H₂SO₄) = 2* 0,1 = 0,2 М
pH = - lg[H⁺] = - lg0.2 = 0.7
Ответ: pH = 0,7
Ответ дал:
0
Напиши как константу диссоциации делал
Ответ дал:
0
В этом случае она не нужна
Ответ дал:
0
потому что серная кислота сильная
Ответ дал:
0
Понял
Ответ дал:
0
степень диссоциации принимается равной 1 или 100%. Вся кислота считается продиссоциировавшей
Ответ дал:
0
................................................................................................
Приложения:
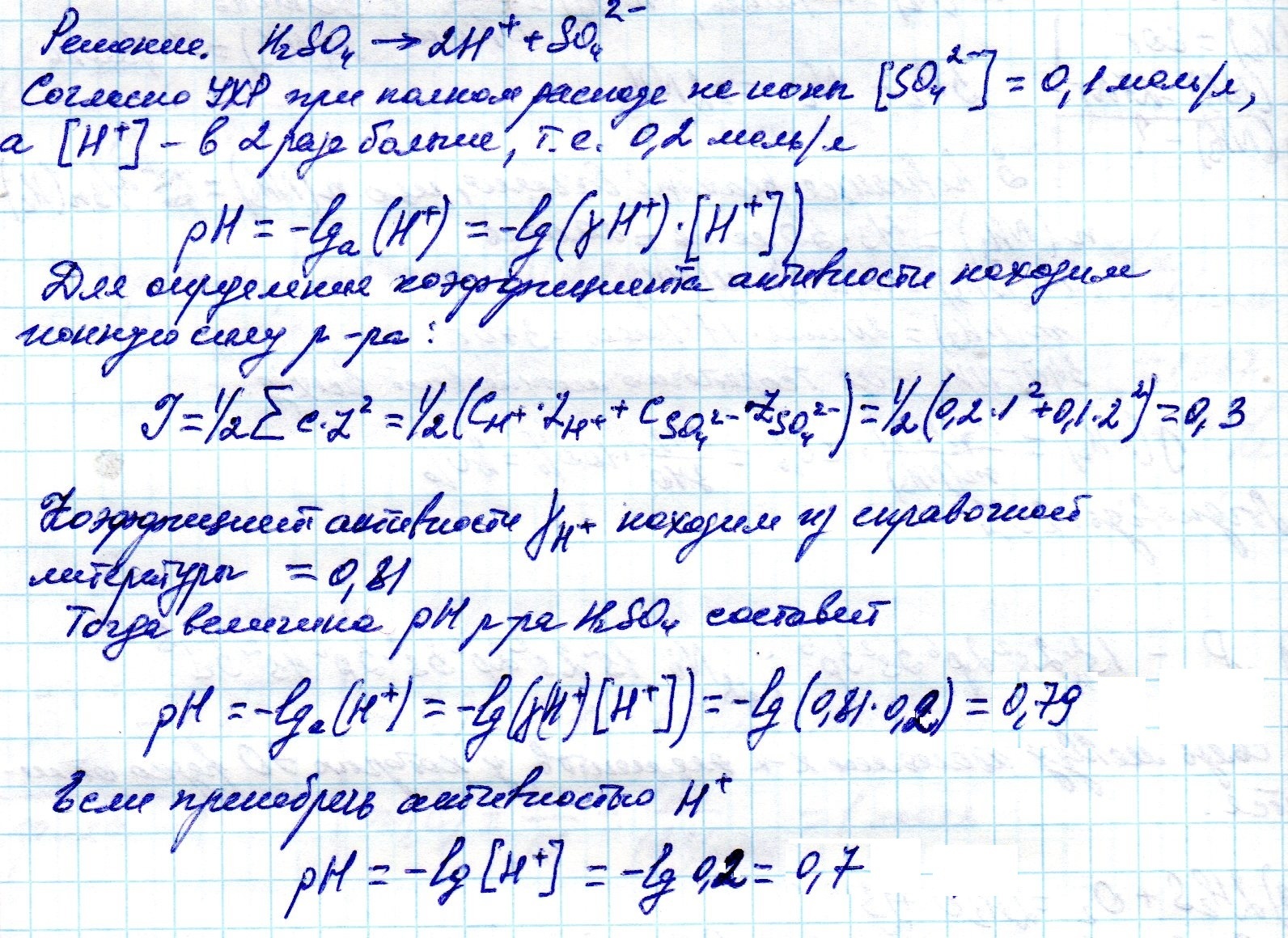
Вас заинтересует
6 лет назад
9 лет назад
9 лет назад
9 лет назад