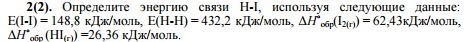Ответы
Ответ дал:
2
Попытался построить здесь энтальпийную диаграмму, но не получилось. Поэтому диаграмма - в скане.
Текстовый ответ - здесь.
1) Йодоводород можно получить напрямую из элементов в стандартном состоянии - H2(г) и J2(тв):
H2(г) + J2(тв) = 2 HJ(г), ΔH1 = 2 ΔH°f(HJ(г))
множитель 2 появляется, потому что образуется не 1, а 2 моль HJ
2) С другой стороны, йодоводород можно получить из йода и водорода другим путем, через несколько стадий.
а) Сначала превратим твердый йод в газообразный:
J2(тв) = J2(г), ΔHа = ΔH°f(J2(г))
(фактически, это теплота перехода йода из твердого состояния в газообразное, или иначе, теплота сублимации, возгонки)
б) Затем газообразные водород и йод атомизируем - превращаем из молекул в атомы. Теплоты процессов равны энергиям соответствующих связей:
H2(г) = 2 H(г), ΔHб1 = E(H-H)
J2(г) = 2 J(г), ΔHб2 = E(J-J)
в) Затем из атомов йода и водорода получаем молекулы йодоводорода:
2 H(г) + 2 J(г) = 2 HJ(г), ΔHв = -2 E(H-J)
Знак минус, так как происходит обратный процесс - не разрыв связи H-J, а наоборот, ее создание.
Множитель 2 - потому что образуется не 1, а 2 моль йодоводорода.
В итоге по закону Гесса, энтальпии первого и второго способа получения йодоводорода должны совпадать.
ΔH1 = ΔHа + ΔHб1 + ΔHб2 + ΔHв
2ΔH°f(HJ(г)) = ΔH°f(J2(г)) + E(H-H) + E(J-J) - 2E(H-J)
2*26.36 = 62.43 + 432.2 + 148.8 - 2*E(H-J)
52.72 = 643,43 - 2*E(H-J)
-590,71 = -2*E(H-J)
E(H-J) = 295,355
E(H-J) = 295,36 кДж/моль
Текстовый ответ - здесь.
1) Йодоводород можно получить напрямую из элементов в стандартном состоянии - H2(г) и J2(тв):
H2(г) + J2(тв) = 2 HJ(г), ΔH1 = 2 ΔH°f(HJ(г))
множитель 2 появляется, потому что образуется не 1, а 2 моль HJ
2) С другой стороны, йодоводород можно получить из йода и водорода другим путем, через несколько стадий.
а) Сначала превратим твердый йод в газообразный:
J2(тв) = J2(г), ΔHа = ΔH°f(J2(г))
(фактически, это теплота перехода йода из твердого состояния в газообразное, или иначе, теплота сублимации, возгонки)
б) Затем газообразные водород и йод атомизируем - превращаем из молекул в атомы. Теплоты процессов равны энергиям соответствующих связей:
H2(г) = 2 H(г), ΔHб1 = E(H-H)
J2(г) = 2 J(г), ΔHб2 = E(J-J)
в) Затем из атомов йода и водорода получаем молекулы йодоводорода:
2 H(г) + 2 J(г) = 2 HJ(г), ΔHв = -2 E(H-J)
Знак минус, так как происходит обратный процесс - не разрыв связи H-J, а наоборот, ее создание.
Множитель 2 - потому что образуется не 1, а 2 моль йодоводорода.
В итоге по закону Гесса, энтальпии первого и второго способа получения йодоводорода должны совпадать.
ΔH1 = ΔHа + ΔHб1 + ΔHб2 + ΔHв
2ΔH°f(HJ(г)) = ΔH°f(J2(г)) + E(H-H) + E(J-J) - 2E(H-J)
2*26.36 = 62.43 + 432.2 + 148.8 - 2*E(H-J)
52.72 = 643,43 - 2*E(H-J)
-590,71 = -2*E(H-J)
E(H-J) = 295,355
E(H-J) = 295,36 кДж/моль
Приложения:

Вас заинтересует
1 год назад
1 год назад
2 года назад
2 года назад
3 года назад