Углекислый газ ,полученный при сжигании 4,48 л метана (н.у) пропустили через раствор гидроксида натрия.Определите массу образовавшегося карбоната натрия
Ответы
Ответ дал:
0
Тут без "дано", но все уравнения на месте. Ответ: 21,2г
Приложения:
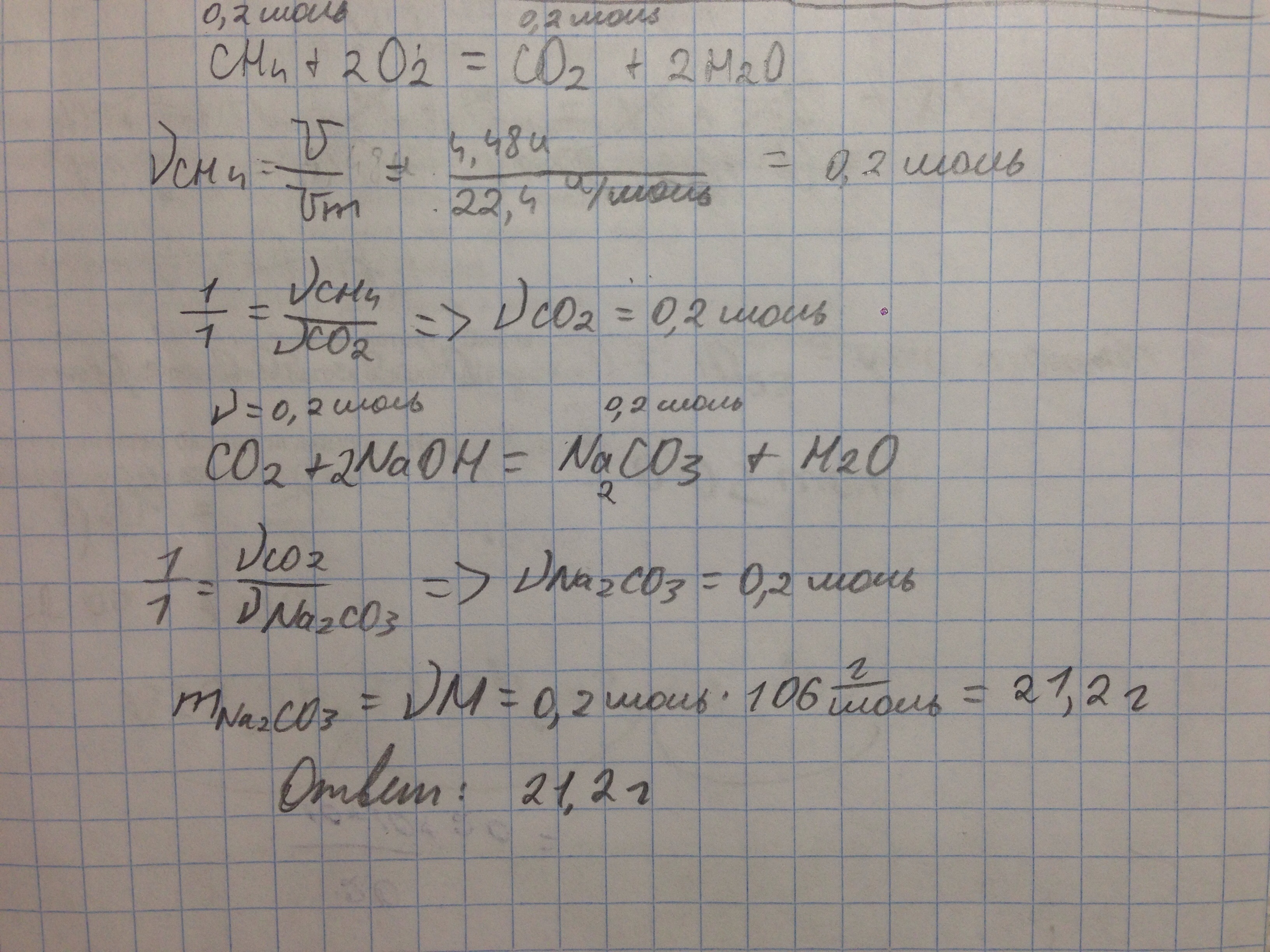
Ответ дал:
0
дано
V(CH4)=4.48 L
----------------------
m(Na2CO3)-?
CH4+2O2-->CO2+2H2O
CO2+2NaOH-->Na2CO3+H2
Vm=22.4L/mol
n(CH4)=V/Vm=4.48/22.4=0.2 mol
n(CH4)=n(Na2CO3)=0.2 mol
M(Na2CO3)=106 g/mol
m(Na2CO3)=n*M=0.2*106=21.2 g
ответ 21.2г
V(CH4)=4.48 L
----------------------
m(Na2CO3)-?
CH4+2O2-->CO2+2H2O
CO2+2NaOH-->Na2CO3+H2
Vm=22.4L/mol
n(CH4)=V/Vm=4.48/22.4=0.2 mol
n(CH4)=n(Na2CO3)=0.2 mol
M(Na2CO3)=106 g/mol
m(Na2CO3)=n*M=0.2*106=21.2 g
ответ 21.2г
Приложения:
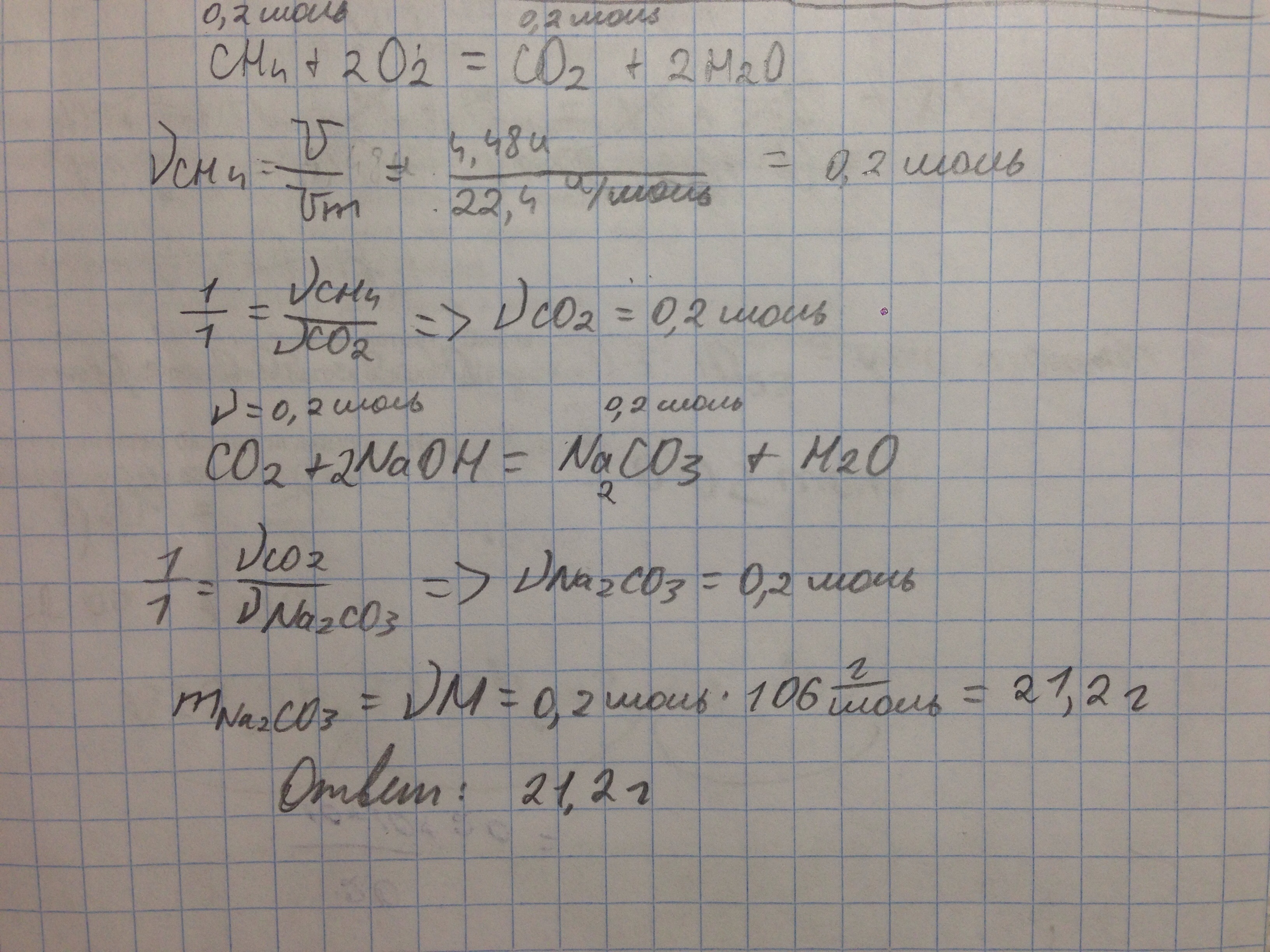
Вас заинтересует
2 года назад
2 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад