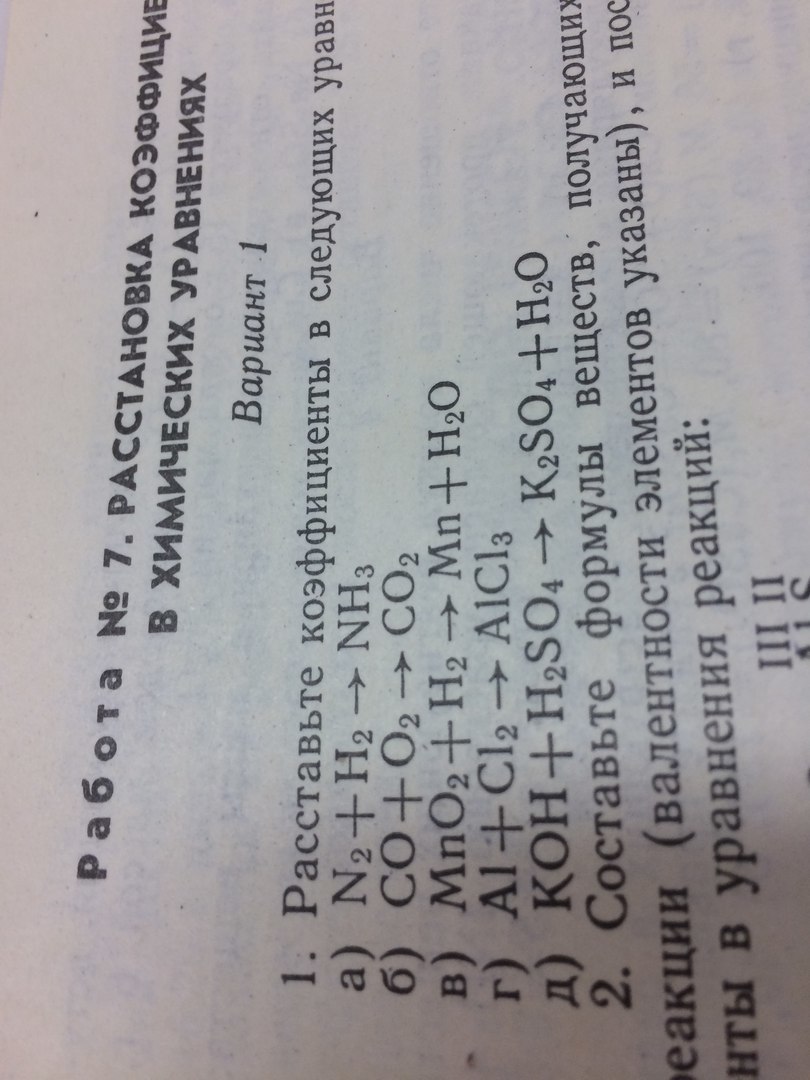Ответы
Ответ дал:
0
1.
а)
Если помог, нажми кнопку Спасибо))
а)
N2(0)+H2(0)=N(-3)H(+)3
N2(0)+ 6e=2N(-3)|1 окислитель, в-е
H2(0)-2e=2H(+) |3 восстановитель, ок-е
N2+3H2=2NH3
б)С (+2) -2ē => С (+4) | 2 | восстановитель, окисление
2О (0) +4ē => 2O (-2) | 1| окислитель, восстановление
2CO+O2=2CO2
в)+4 -2 0 +2-2
+1-2
MnO2 + H2 = MnO + H2O
1| H2[0]
-2e = 2H[+1] | 1 восстановитель, окисление
1|Mn[+4]
+2e = Mn[+2] | 1 окислитель, восстановление
г)Al-3e=Al+3 |2 восстановитель, окисление
Cl2+2e=2Cl- |3 окислитель, восстановление
2Al+3Cl2=2AlCl3
д)2КОН + Н2SO4=К2SO4+2Н2О
Тут не чего не изменяется, просто подбираемЕсли помог, нажми кнопку Спасибо))
Вас заинтересует
2 года назад
2 года назад
3 года назад
3 года назад
9 лет назад
10 лет назад