Даю 12 баллов!!!!!Срочно помогите плз с задачей!!с объяснениями и все понятно и словами объясните каждый шаг прошууу учитель требует..
Сколько литров (н.у.) аммиака можно получить при взаимодействии избытка гашеной извести с хлоридом аммония массой 117 г, содержащим 10 г примеси. Сколько моль гашеной извести вступит в реакцию? Mr(NH4Cl) = 53,5.
Ответы
Ответ дал:
0
говоорится что из 117 грамм , 10 грамм это примеси , поэтому 117-10=107грамм у нас NH4Cl.
Пишем реакцию, и уравняем .
Потом под NH4Cl пишем ее мольярную массу , и умножаем на коэффициет.Над NH4Cl пишем скодько нам дали , нам дали 107 , значит пишем 107 грамм.
Под аммиаком пишем молекулярную массу и умножаем на коэффициент. А над аммиаком пишем Х.
По пропорции находим х.Получается 44.8 литра.По реакции видим, что вступает в реакцию всего лишь 1 моль гашеной извести.
Пишем реакцию, и уравняем .
Потом под NH4Cl пишем ее мольярную массу , и умножаем на коэффициет.Над NH4Cl пишем скодько нам дали , нам дали 107 , значит пишем 107 грамм.
Под аммиаком пишем молекулярную массу и умножаем на коэффициент. А над аммиаком пишем Х.
По пропорции находим х.Получается 44.8 литра.По реакции видим, что вступает в реакцию всего лишь 1 моль гашеной извести.
Приложения:
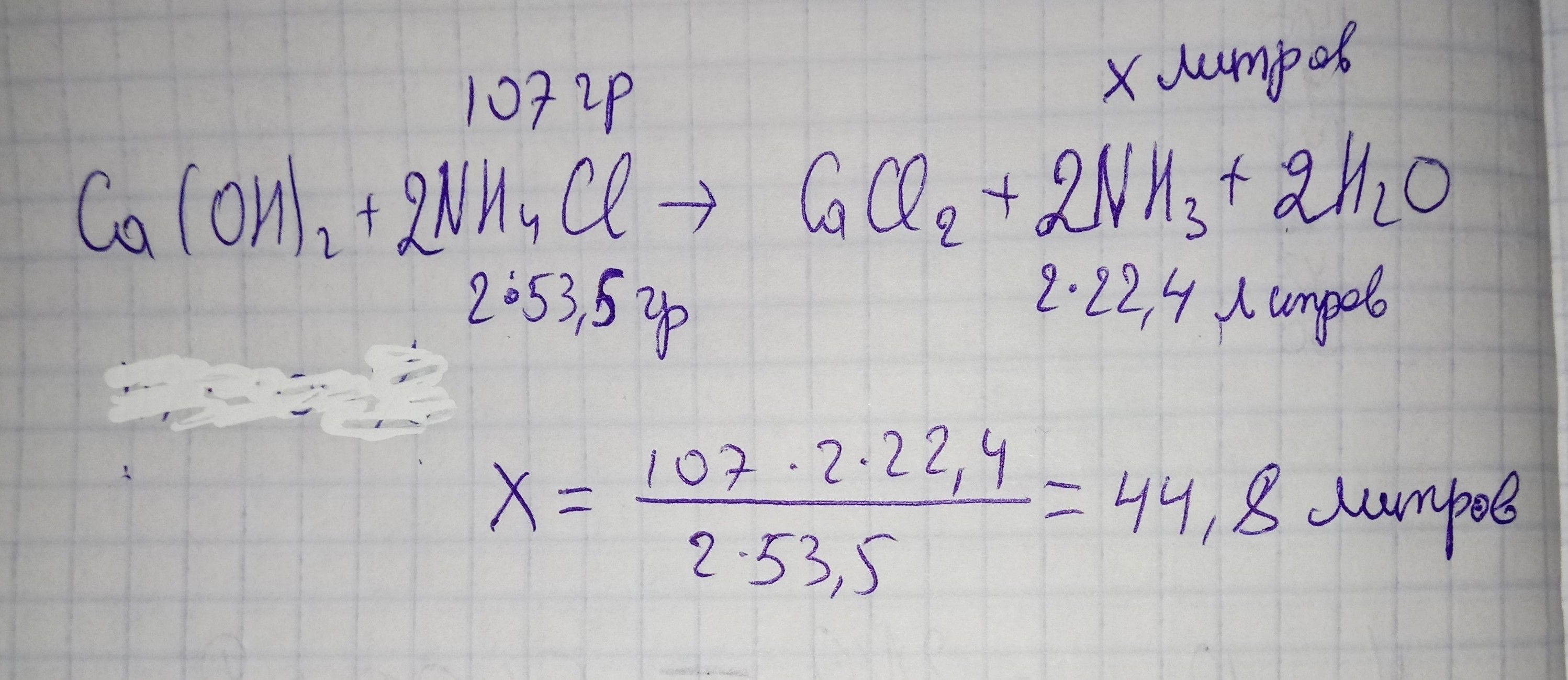
Вас заинтересует
2 года назад
3 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад