дай 50 баллов за подробное решение 2(б) и все пожалуйста помогите и лучший ответ если все хорошо
Приложения:
Ответы
Ответ дал:
0
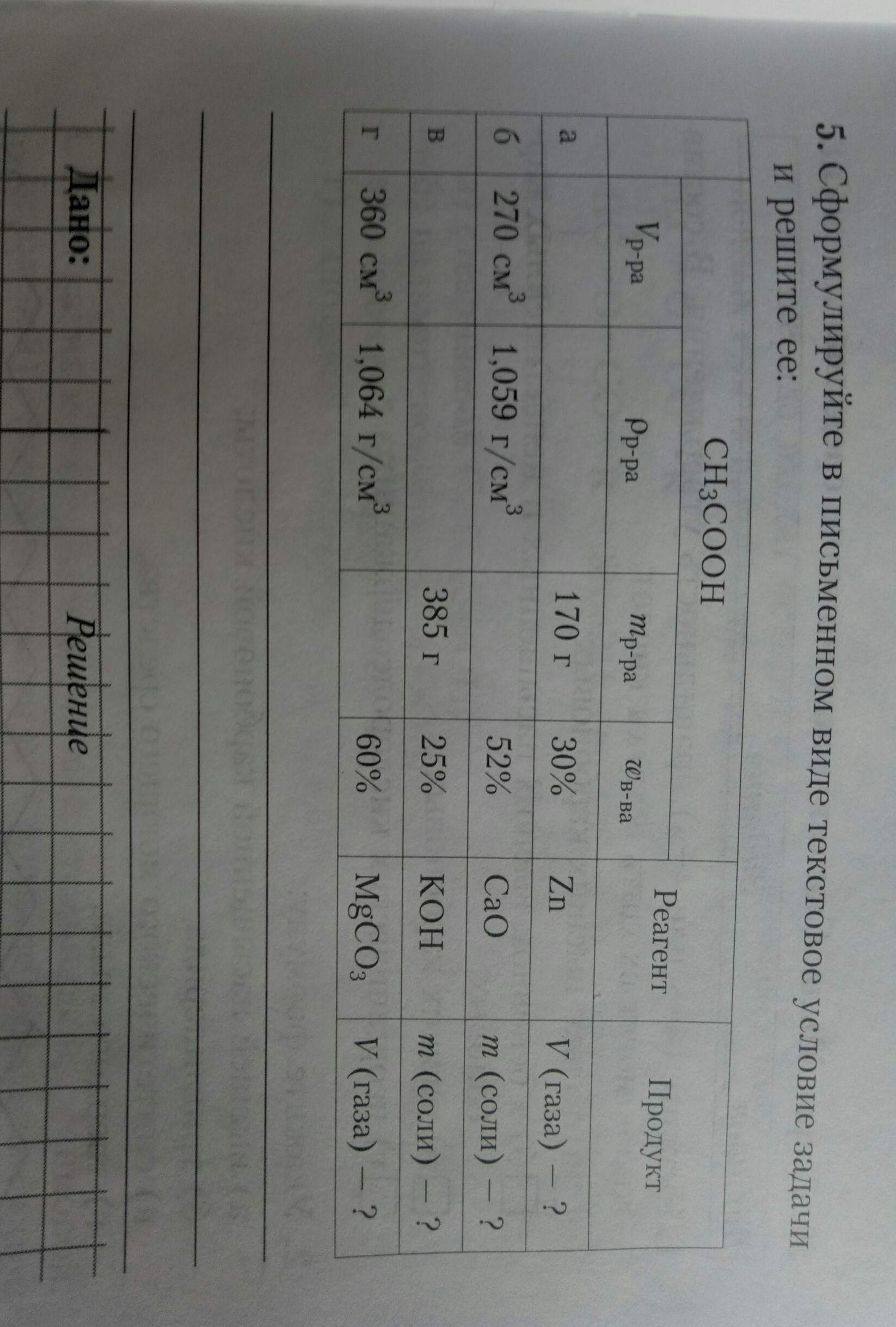
К 270 см³ уксусной кислоты (p=1,059 г/см³), массовая доля в растворе которой равна 52%, добавили оксид кальция. Вычислите массу получившийся в ходе реакции соли.
Решение:
2CH3COOH + CaO = (CH3COO)2Ca + H2O
m(р-ра уксусной к-ты) = V*p = 270 см³ * 1,059 г/см³ = 285,93 г
m(уксусной к-ты) = m(p-pa)*w = 285,93 г * 0,52 = 148, 68 г
n(укс. к-ты) = m/M = 148,68г/ 60,05 г/моль = 2,48 моль
n((CH3COO)2Ca) = 0,5n(CH3COOH) = 1,24 моль - по уравнению хим. реакции
m((CH3COO)2Ca)) = n*M = 1,24 моль * 158,17 г/моль = 196,13 г
Ответ: 196,13 г
Решение:
2CH3COOH + CaO = (CH3COO)2Ca + H2O
m(р-ра уксусной к-ты) = V*p = 270 см³ * 1,059 г/см³ = 285,93 г
m(уксусной к-ты) = m(p-pa)*w = 285,93 г * 0,52 = 148, 68 г
n(укс. к-ты) = m/M = 148,68г/ 60,05 г/моль = 2,48 моль
n((CH3COO)2Ca) = 0,5n(CH3COOH) = 1,24 моль - по уравнению хим. реакции
m((CH3COO)2Ca)) = n*M = 1,24 моль * 158,17 г/моль = 196,13 г
Ответ: 196,13 г
Ответ дал:
0
спасибо))) ❤❤❤
Вас заинтересует
2 года назад
3 года назад
3 года назад
9 лет назад
9 лет назад