Сколько граммов карбида алюминия получится при взаимодействии 108г алюминия и 108г углерода? Выход продукта составляет 50%. Ar(C)=12, Ar(Al)=27
Ответы
Ответ дал:
0
Ну нинаю...
4Al+3C→Al4C3
m(Al) = n*M = 4*27 = 108г
m(C) = n*M = 3*12 = 36г
m(Al4C3) = n*M = 1*(27*4+12*3) = 144г
n(C) = 108/12 = 9моль
n(Al) = 108/27 = 4моль
Al в недостатке.
108 - x
108 - 144
x = 144
(= Возможно неправильно, я не уверен в своем решении =)
4Al+3C→Al4C3
m(Al) = n*M = 4*27 = 108г
m(C) = n*M = 3*12 = 36г
m(Al4C3) = n*M = 1*(27*4+12*3) = 144г
n(C) = 108/12 = 9моль
n(Al) = 108/27 = 4моль
Al в недостатке.
108 - x
108 - 144
x = 144
(= Возможно неправильно, я не уверен в своем решении =)
Ответ дал:
0
.............................
Приложения:
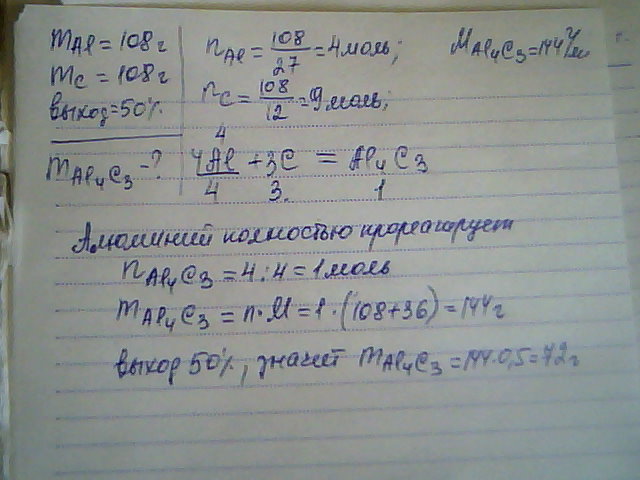
Вас заинтересует
2 года назад
3 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад