ПОМОГИТЕ!!! СРОЧНО!!! ХИМИЯ. С 13 ЗАДАНИЯ ПО 18. ОЧЕНЬ ПРОШУ. С ФОТО. НУ. ЛИБО ТАК. НО ПОНЯТНО.
Приложения:
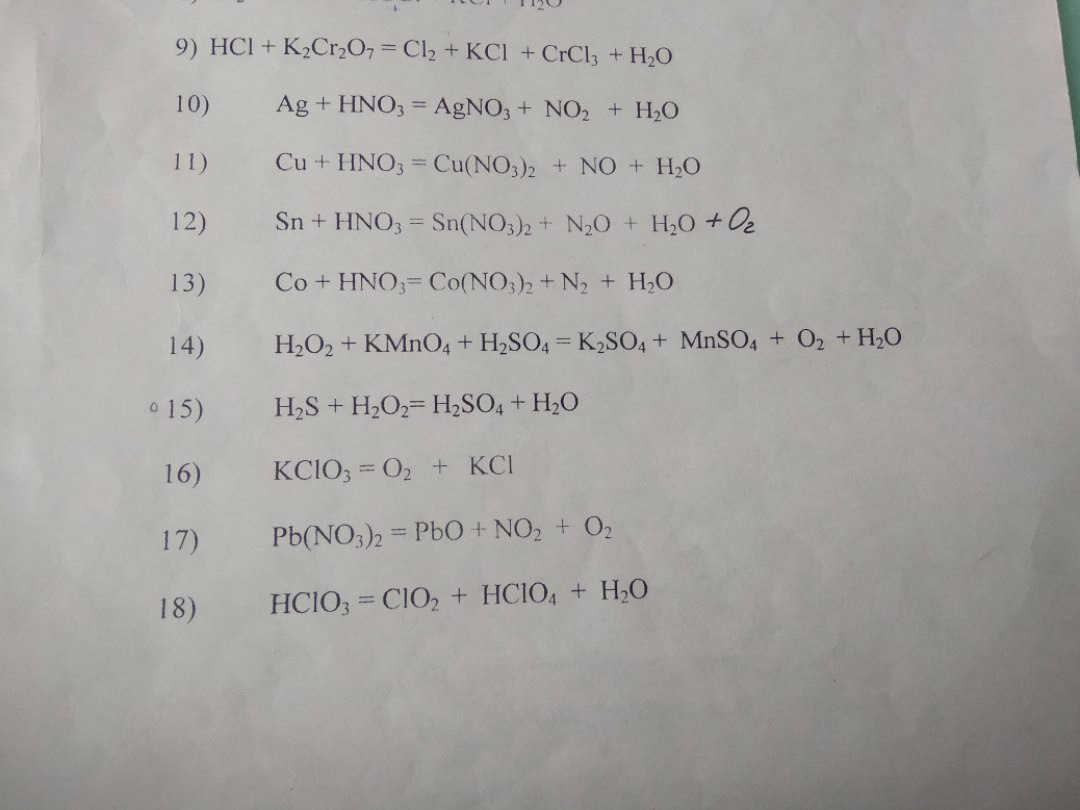
Ответы
Ответ дал:
0
13. 5Co + 12HNO3 = 5Co(NO3)2 + N2 + 6H2O
14. 5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O
15. H2S + 4H2O2 = H2SO4 + 4H2O
16. 2KClO3 = 2KCl + 3O2
17. 2Pb(NO3)2 = 2PbO + 4NO2 + O2
18. 3HClO3 = HClO4 + 2ClO2 + H2O
14. 5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O
15. H2S + 4H2O2 = H2SO4 + 4H2O
16. 2KClO3 = 2KCl + 3O2
17. 2Pb(NO3)2 = 2PbO + 4NO2 + O2
18. 3HClO3 = HClO4 + 2ClO2 + H2O
Приложения:
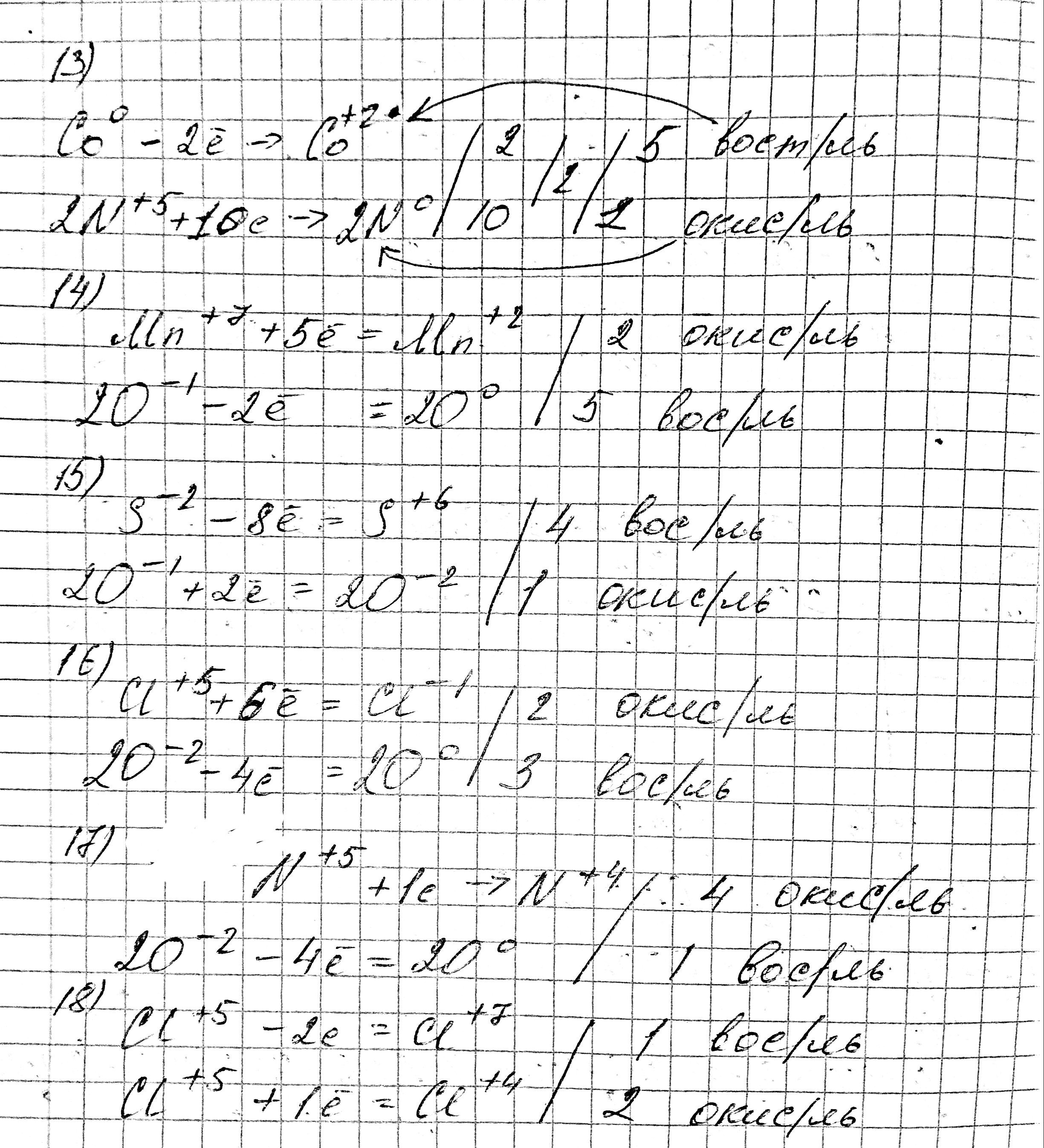
Ответ дал:
0
Допустим, что я поняла. Но, мне нужен точный ответ с общими множителями. Если не трудно
Ответ дал:
0
Вот огроменные извинения.) Но. Я в химии глупенькая и как-то на свой лад не раскручу.
Ответ дал:
0
Хотите сказать откуда нашел эти коэффициенты стоящие перед веществами
Ответ дал:
0
Ох. Как по-немецки.) Я ж все поняла. Но это решение не удовлетворит моего учителя химии. По схеме ОВР. Кто меняет степени, расписать, кто забирает, отдает электроны и общий коэфициент с окис. Либо восстановителем.
Ответ дал:
0
Если вы согласны на полный ответ по моему заданию. То отпишитесь. С фото, потому что здесь такое не напишешь. Отпишитесь, пожалуйста
Ответ дал:
0
13. 5Co⁰ + 12HN⁺⁵O3 = 5Co⁺²(NO3)2 + N₂⁰ + 6H2O
Co⁰ - 2e⁻ = Co⁺² | 5 - восстановитель, процесс окисления
2N⁺⁵ + 10e⁻ = N₂⁰ | 1 - окислитель,процесс восстановления
14. 5H₂O₂⁺¹ + 2KMn⁺⁷O₄ + 3H₂SO₄ = K₂SO₄ + 2Mn⁺²SO₄ + 5O₂⁰ + 8H₂O
2О⁺¹ - 2e⁻ = O₂⁰ | 5 - восст-ль, пр. ок-я
Mn⁺⁷+ 5e⁻ = Mn⁺² | 2 - ок-ль, пр. восст-я
15. H₂S⁻² + 4H₂O₂⁻¹ = H₂S⁺⁶O₄ + 4H₂O⁻²
S⁻² -8e⁻ = S⁺⁶ | 1 - восст-ль, пр. ок-я
2O⁻¹ + 2e⁻ = 2O⁻² | 4- ок-ль, пр. восст-я
16. 2KCl⁺⁵O₃⁻² = 2KCl⁻ + 3O₂⁰
Cl⁺⁵ + 6e⁻ = Cl⁻ | 2 - ок-ль, пр. в-я
2O⁻² + 4e⁻= O₂⁰ | 3 - в-ль, пр. ок-я
17. 2Pb(N⁺⁵O₃⁻²)₂ = 2PbO + 4N⁺⁴O₂ + O₂⁰
N⁺⁵ +e⁻ = N⁺⁴ | 4 - ок-ль, пр. в-я
2O⁻² - 4e⁻ = O₂⁰ |1 - в-ль, пр. ок-я
18. 3HCl⁺⁵O₃ = HCl⁺⁷O₄ + 2Cl⁺⁴O₂ + H₂O
Сl⁺⁵ - 2e = Cl⁺⁷ | 1 - в-ль, пр.ок-я
Cl⁺⁵ + e⁻ = Cl⁺⁴ | 2 - ок-ль, пр. в-я
Co⁰ - 2e⁻ = Co⁺² | 5 - восстановитель, процесс окисления
2N⁺⁵ + 10e⁻ = N₂⁰ | 1 - окислитель,процесс восстановления
14. 5H₂O₂⁺¹ + 2KMn⁺⁷O₄ + 3H₂SO₄ = K₂SO₄ + 2Mn⁺²SO₄ + 5O₂⁰ + 8H₂O
2О⁺¹ - 2e⁻ = O₂⁰ | 5 - восст-ль, пр. ок-я
Mn⁺⁷+ 5e⁻ = Mn⁺² | 2 - ок-ль, пр. восст-я
15. H₂S⁻² + 4H₂O₂⁻¹ = H₂S⁺⁶O₄ + 4H₂O⁻²
S⁻² -8e⁻ = S⁺⁶ | 1 - восст-ль, пр. ок-я
2O⁻¹ + 2e⁻ = 2O⁻² | 4- ок-ль, пр. восст-я
16. 2KCl⁺⁵O₃⁻² = 2KCl⁻ + 3O₂⁰
Cl⁺⁵ + 6e⁻ = Cl⁻ | 2 - ок-ль, пр. в-я
2O⁻² + 4e⁻= O₂⁰ | 3 - в-ль, пр. ок-я
17. 2Pb(N⁺⁵O₃⁻²)₂ = 2PbO + 4N⁺⁴O₂ + O₂⁰
N⁺⁵ +e⁻ = N⁺⁴ | 4 - ок-ль, пр. в-я
2O⁻² - 4e⁻ = O₂⁰ |1 - в-ль, пр. ок-я
18. 3HCl⁺⁵O₃ = HCl⁺⁷O₄ + 2Cl⁺⁴O₂ + H₂O
Сl⁺⁵ - 2e = Cl⁺⁷ | 1 - в-ль, пр.ок-я
Cl⁺⁵ + e⁻ = Cl⁺⁴ | 2 - ок-ль, пр. в-я
Приложения:
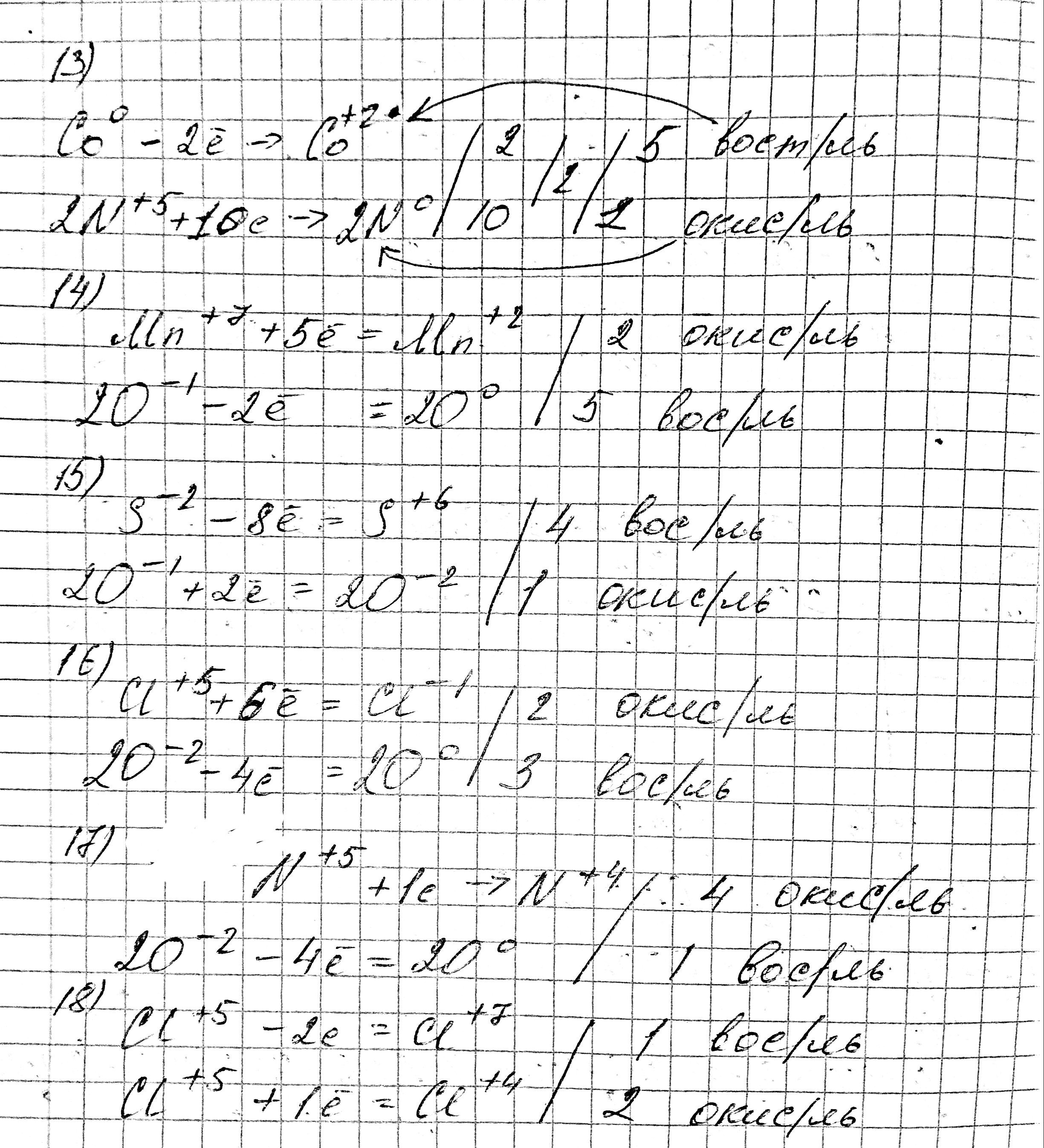
Вас заинтересует
2 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад
10 лет назад