Почему при уменьшении давления смещается равновесие реакции N2газ+3H2 газ↔ 2NH3 газ и не смещается равновесие реакции N2 газ +02 газ ↔ 2N0 газ.
Ответы
Ответ дал:
0
При повышении давления в закрытой системе равновесие будет смещаться в сторону образования веществ с меньшим объемом.
Если проанализировать данные уравнения, то видим, что в реакции
N2газ+3H2 газ↔ 2NH3 газ
вступает в реакцию 1 объем азота + 3 объема водорода( всего 4), а образуется аммиак 2 объема. Значит равновесие сместится в сторону аммиака.
В реакции
N2 газ +02 газ ↔ 2N0 газ.
вступает 2 и образуется 2 объема, равновесие не смещается , а увеличатся только скорости прямойи обратной реакций.
Приложения:
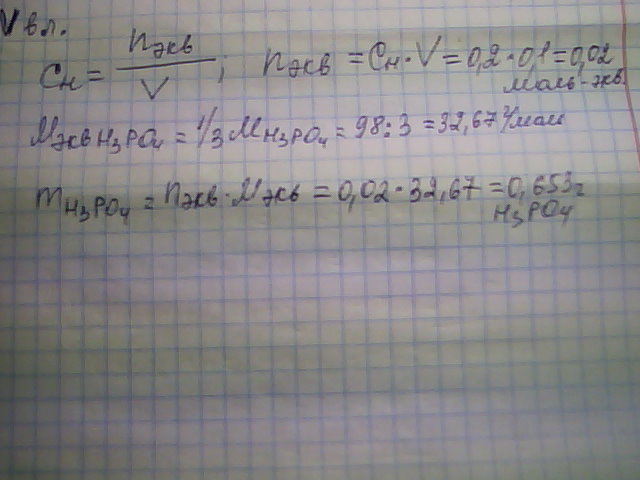
Ответ дал:
0
Спасибо,а можете с другими заданиями помочь???
Ответ дал:
0
Сколько граммов растворённого вещества содержится в 200 мл 0,1 Н раствора Н3РО4?
Ответ дал:
0
Как изменится скорость реакции 2N0 газ +02 газ ↔ 2N02 газ, если увеличить давление в системе в 3 раза?
Ответ дал:
0
Оксид хлора содержит 47,42 % кислорода. Плотность пара его но водороду 33,73. Вывести формулу этого оксида.
Ответ дал:
0
При горении 6,2 г фосфора расходуется 4,8г кислорода. Вычислить эквивалентную массу фосфора, если эквивалентная масса кислорода равна 8 г/моль.
Вас заинтересует
2 года назад
3 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад