1)Вычислите массовую долю (%) азотной кислоты в растворе , если известно , что 200 г этого раствора полностью прореагировали с 4 г гидроксида натрия.
2) Рассчитайте массу раствора азотной кислоты (Массовую долю HNO3 в нем равна 14%) , которую необходимо затратить на реакцию с 2 моль карбоната натрия.
3) Раствор ортофосфорной кислоты массой 49 кг с массовой долей H3PO4 50% нейтрализовали гидроксидом кальция.Определите массу образовавшегося фосфата кальция.
4) Составьте молекулярную и ионные уравнения реакций ортофосфорной кислоты: а)с кальцием; б)с оксидом кальция; в) с гидроксидом кальция , взятым в избытке ; в недостатке.Под формулами запишите названия соответствующих веществ.
P.S. желательно с объяснением.
Ответы
Ответ дал:
0
1. Дано:
m(p-pa HNO3) = 200 г
m(NaOH) = 4 г
Найти:
ω(p-pa HNO3)=?
Решение.
M(NaOH) = 40 г/моль
n(NaOH) = 4 г/40 г/моль = 0,1 моль
HNO3 + NaOH = NaNO3 + H2O
Из УХР следует, что n(HNO3)=n(NaOH) = 0,1 моль
M(HNO3) = 63 г/моль
m(HNO3) = 0,1 моль * 63 г/моль = 6,3 г
ω(HNO3) = 6,3 г/200 г = 0,0315 или 3,15%
Ответ: 3,15%
Приложения:


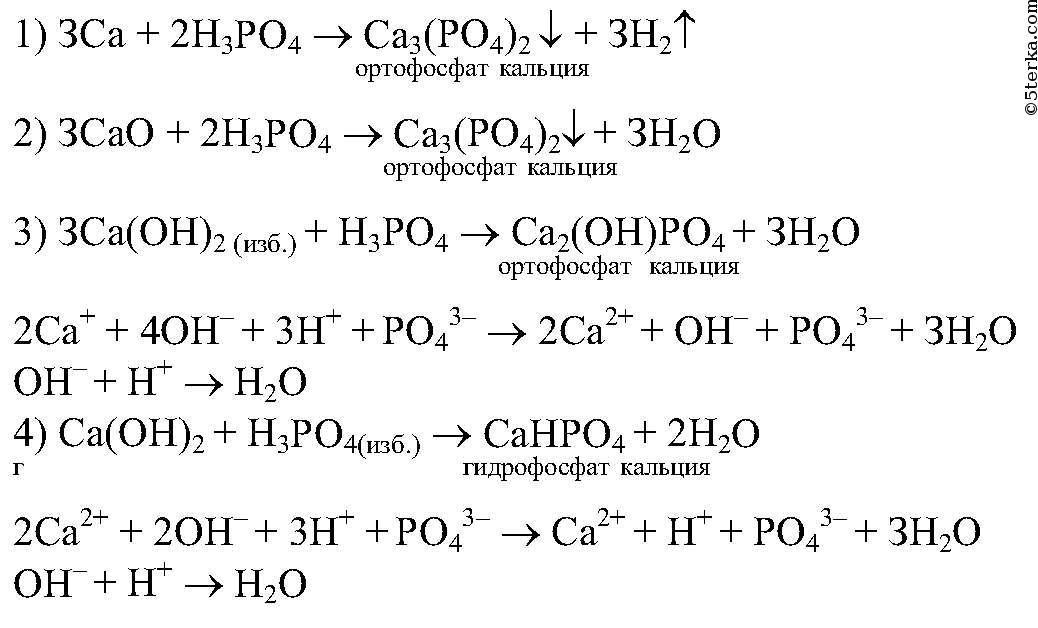
Вас заинтересует
2 года назад
2 года назад
3 года назад
3 года назад
9 лет назад
9 лет назад
10 лет назад
10 лет назад