сколько грамм осадка образуется при взаимодействии раствора гидроксида натрия массой 120г с массовой щёлочи 30% с раствором хлорида цинка?
Ответы
Ответ дал:
0
Ответ:
Масса осадка гидроксида цинка 2 равна 44,55 граммам
Приложения:
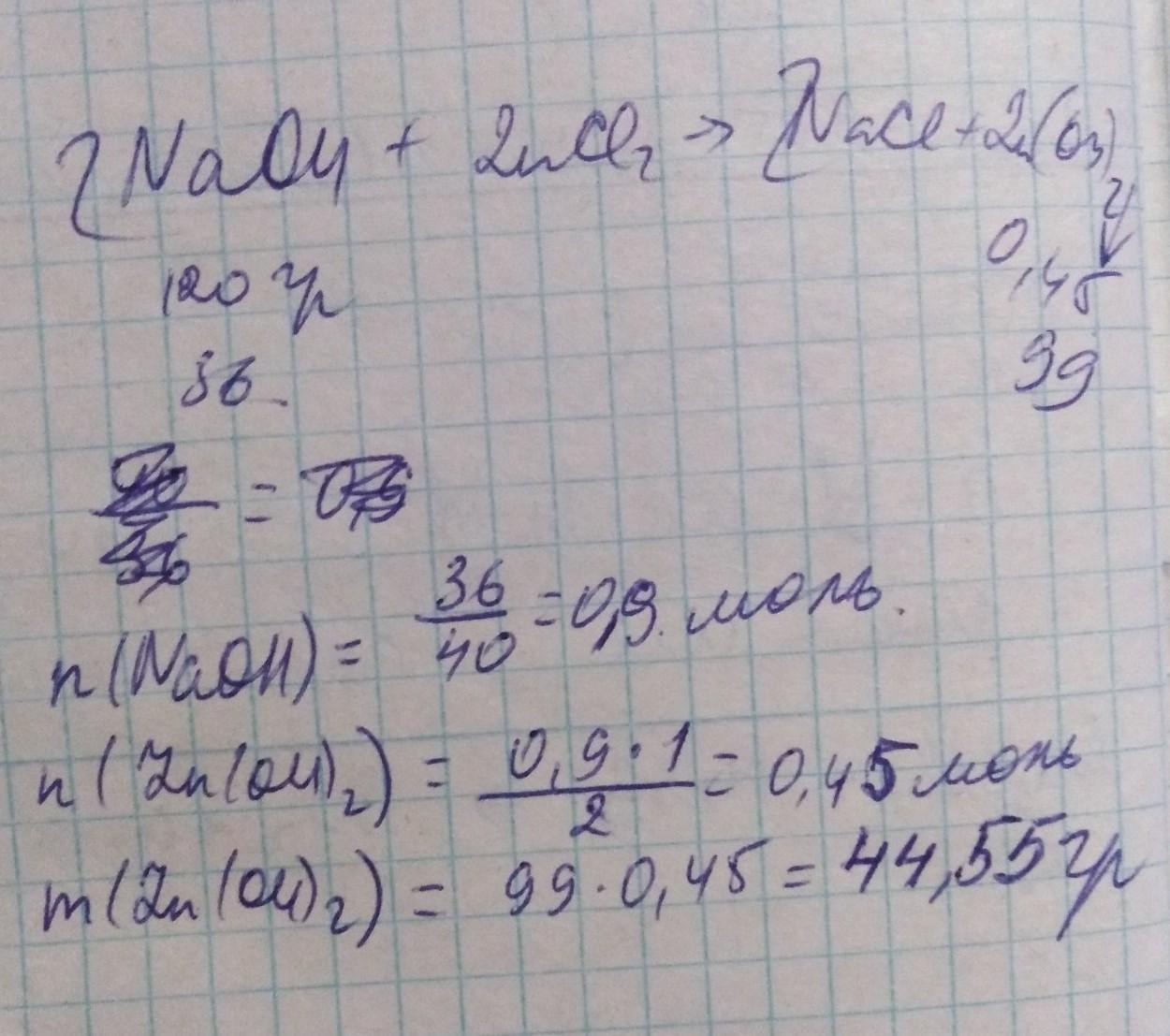
Ответ дал:
0
Ответ:
m(ZN(OH)₂ = 44.55г
Объяснение:
Дано:
m(NaOH(р-р)) = 120г
ω(NaOH) = 30% = 0.3
m(Zn(OH)₂) - ?
Решение:
1. составим уравнение реакции
2NaOH(р-р) + ZnCl₂ = 2NaCl + Zn(OH)₂↓
2. вычислим массу NaOH в растворе и его кол-во вещества
m(NAOH) = m(р-ра) * ω(в-ва) = 120г * 0.3 = 36г
n(NAOH) = m / M = 36г / 40г/моль = 0.9 моль
3. вычислим кол-во вещества и массу Zn(OH)₂
n(Zn(OH)₂) = 1/2n(NaOH) = 1/2 * 0.9 моль = 0.45 моль
m(Zn(OH)₂ = n * M = 0.45 моль * 99г/моль = 44.55г
Приложения:
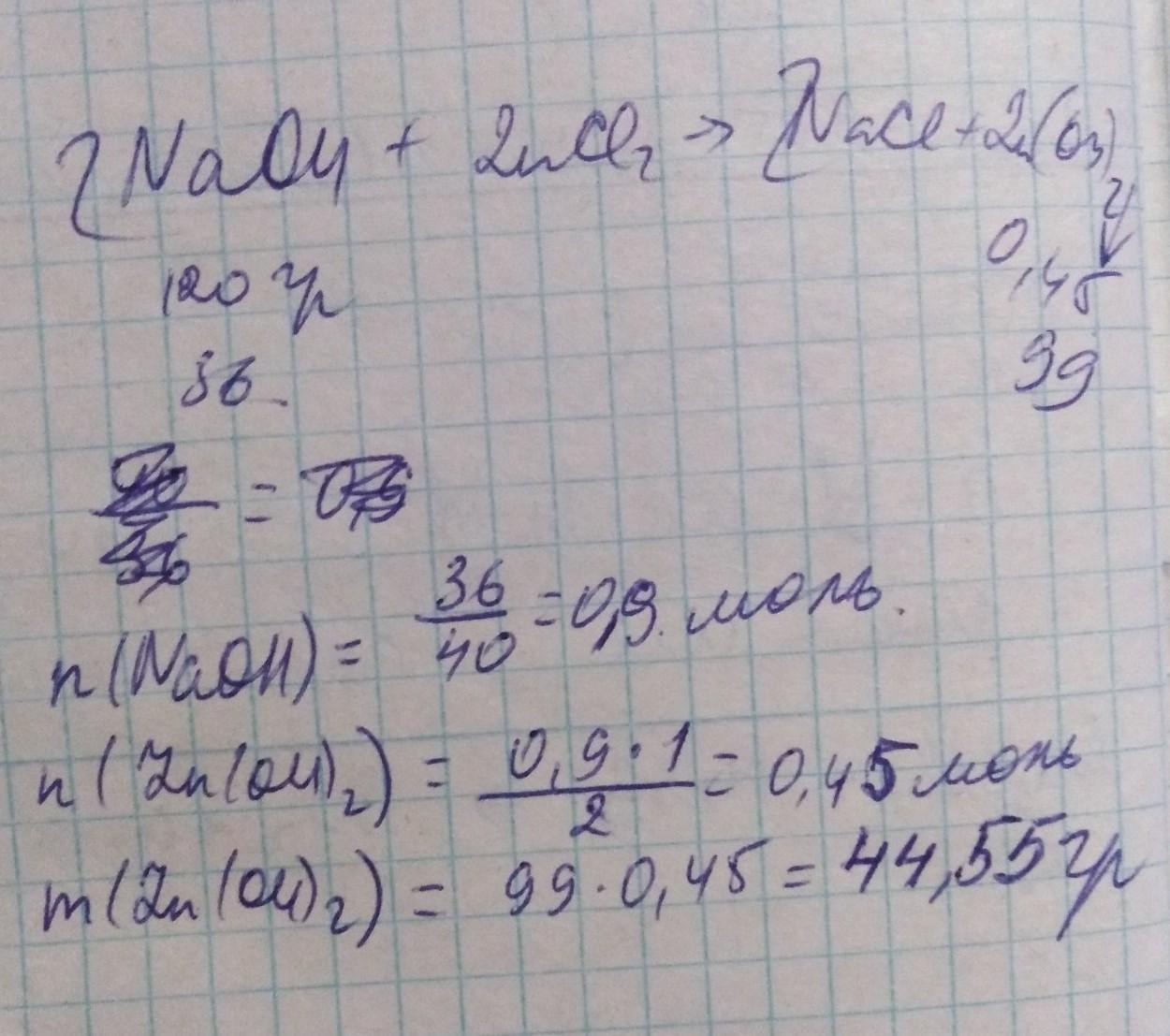
Вас заинтересует
2 года назад
2 года назад
3 года назад
9 лет назад
10 лет назад