Ответы
Ответ:
3483,5 кДж
Объяснение
В реакция горения в избытке кислорода метан окисляется до углекислого газа с выделением тепла:
СН₄ + 2О₂ = СО₂ + 2Н₂О + Q
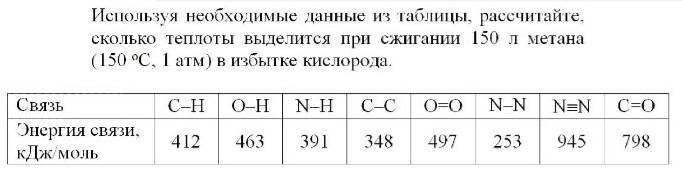
При горении рвутся связи С-Н (4 связи) в метане и О=О в кислороде (так как по уравнению реакции 2 моля, то две) и образуются 2 связи С- Ов СО₂ и 4 О-Н (по 2 в 2 молекулах воды)
Тепловой эффект (при отсутствии фазовых переходов) равен разности между энергиями сумм энергий связей продуктов и исходных в-в.
Q = (2*2*463 + 2*798) - (4*412 + 2*497) = (1852 + 1596) - (648 + 994) = 3448 - 2642 = 806 (кДж/моль)
По условию взято 150 л при 150°С. Для расчета количества метана нужно рассчитать его объем при нормальных условиях по ф-ле:
V = V₀ (1 + t/273). Откуда V₉= V*273/(273+t)
V₀ = 150*273/(273+150) ≈ 96,8 л
Это составляет 96,8 : 22,4 ≈ 4,322 моля
Расчетный тепловой эффект при сгорании такого количества метана:
806 * 4, 322 ≈ 3483,5 (кДж)
Ответ: 3483,5 кДж