Может ли быть вот такая реакция в егэ 30 номере?
5PH3+8HNO3=5H3PO4+4N2+4H20
В условиях прописано что должен ввделиться газ (не указано какой) и образоваться кислота. Но изначально среди списка реагентов не было дано концентрации азотной кислоты, и в теории если учесть что она разбавленная, может же протекать такая реакция? Очень нужно знать, чтобы подавать апелляцию.
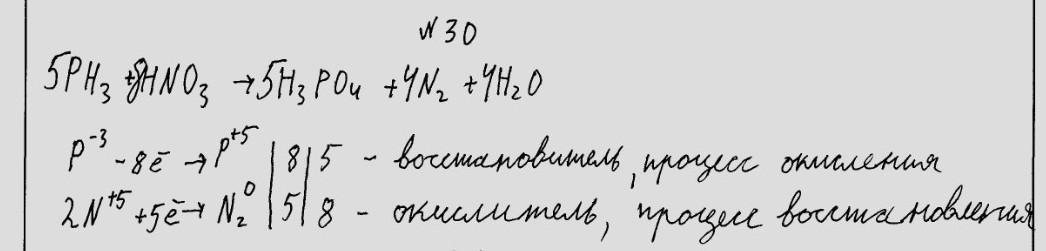
Ответы
Ответ:
Объяснение:
Может ли быть вот такая реакция в егэ 30 номере?
5PH3+8HNO3=5H3PO4+4N2+4H20
В условиях прописано что должен выделиться газ (не указано какой) и образоваться кислота. Но изначально среди списка реагентов не было дано концентрации азотной кислоты, и в теории если учесть что она разбавленная, может же протекать такая реакция? Очень нужно знать, чтобы подавать апелляцию.
Фосфин - сильный восстановитель, азотная кислота - сильный окислитель
Во всех руководствах указывается, что при окислении неметаллов азотной кислотой последняя восстанавливается как правило до
NO2 (концентрированная) и до NO (разбавленная) - вот вам газы.
Фосфин при окислении дает вам ортофосфорную кислоту (вот вам кислота)
РН3 + 8НNO3 (k) = H3PO4 + 8NO2 + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║1
N⁺⁵ + 1e = N⁺⁴ восстановление, НNO3 (k) - окислитель ║8
3РН3 + 8НNO3 (р) = 3H3PO4 + 8NO + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║ 3
N⁺⁵ + 5e = N⁺² восстановление, НNO3 (р) - окислитель ║ 8
5РН3 + 8НNO3 (оч. р) = 5H3PO4 + 4N2 + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║ 5
2N⁺⁵ + 10e = N₂⁰ восстановление, НNO3 (оч.р) - окислитель║ 4
Мне не суждено понять, почему вы выбрали последний вариант.
Если бы вместо фосфина был бы металл средней активности, то я бы смело вам сказал подавайте апелляцию. Но с фосфином ...
Теоретически вроде все верно. Но практически, быть может эта реакция протекает только при строго определенном рН или еще какие особые условия. С такой реакцией мне сталкиваться не приходилось. А вот с апелляцией дважды и оба раза мой ученик проиграл. Словом решать вам.