Подробно распишите пожалуйста
Ответы
Ответ:
Закон Клапейрона-Менделеева:
p*V=N*k*T где V - объём газа; N - число частиц газа в объеме V; k - постоянная Больцмана (всегда равна (Дж/К)); T - температура газа; p - давление газа.
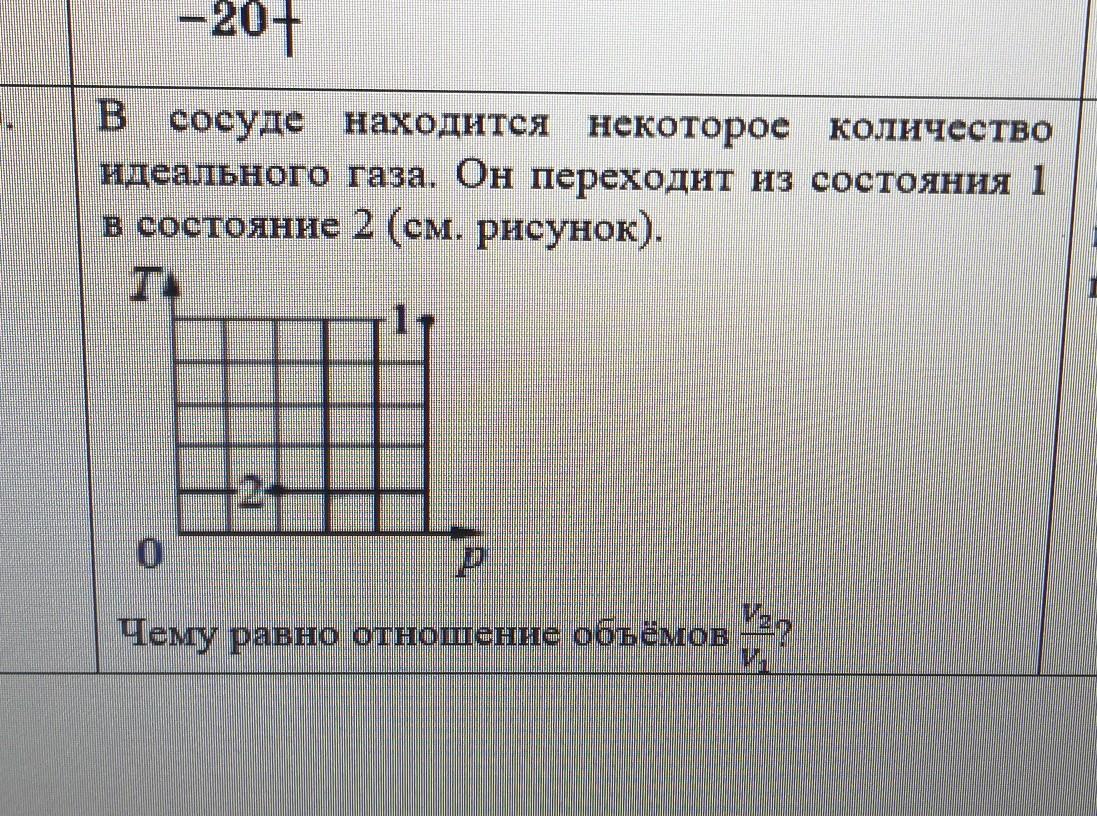
По графику видно, что T1=5, а T2=1 где T1-температура газа в состояние 1; T2-температура газа в состояние 2.
Также по графику видно, что p1=5, а p2=2 где p1-давление газа в состояние 1; p2-давление газа в состояние 2.
Выразим V1 и V2 из закона Клапейрона-Менделеева:
V1=(N*k*T1)/p1
V2=(N*k*T2)/p2
N и k равны в состояние 1 и в состояние 2, так как кол-во частиц мы не изменяем, а k - это константа (то есть неизменная величина) и она всегда равна (Дж/К).
Находим отношение:
V2/V1=((N*k*T2)/p2):((N*k*T1)/p1)=(N*k*T2*p1)/(p2*N*k*T1)=(T2*p1)/(T1*p2)
Подставляем значения из графика:
V2/V1=(T2*p1)/(T1*p2)=(1*5)/(5*2)=5/10=0,5
Ответ: 0,5
Объяснение: