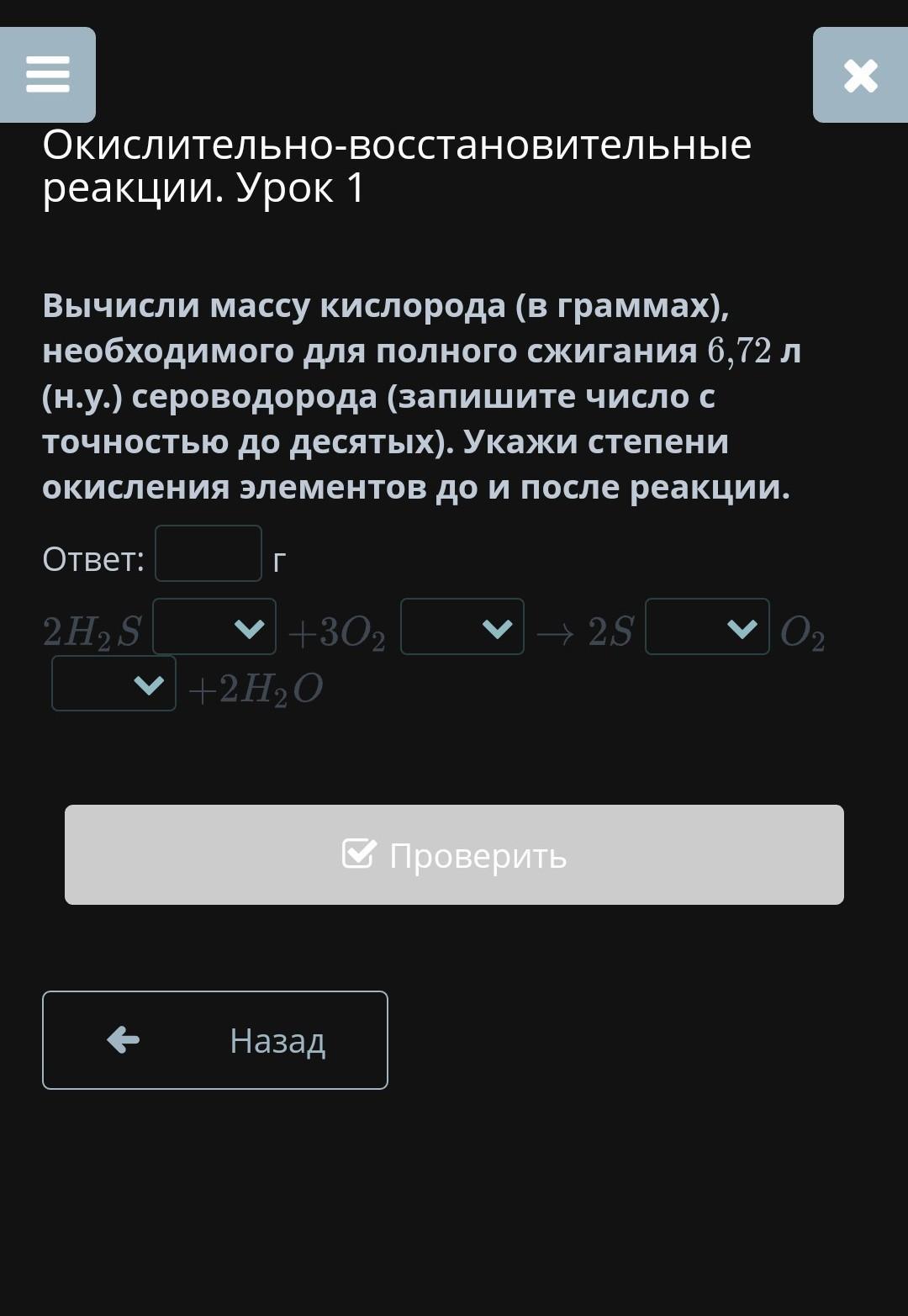
Вычисли массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода (запишите число с точностью до десятых). Укажи степени окисления элементов до и после реакции.
Приложения:
Ответы
Ответ дал:
3
Дано : нормальные условия.
V(H₂S) = 6,72 л.
Найти :
m(О₂) = ?
Решение :
Составим уравнение химической реакции и расставим степени окисления элементов - .
n = (V
= 22,4 л/моль при нормальных условиях) ⇒ n(H₂S) = V(H₂S) : V
= 6,72 л : 22,4 л/моль = 0,3 моль.
По уравнению реакции - 3n(H₂S) = 2n(O₂) = 3*0,3 моль = 0,9 моль ⇒ n(O₂) = 0,9 моль : 2 = 0,45 моль.
n = ⇒ m(O₂) = n(O₂)*M(O₂) = 0,45 моль*32 г/моль = 14,4 г.
Ответ :
14,4 г.
Вас заинтересует
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
8 лет назад
9 лет назад