Знатоки химии, срочно нужна ваша помощь!
Напишите выражения для константы равновесия следующих обратимых реакций :
(на фото)
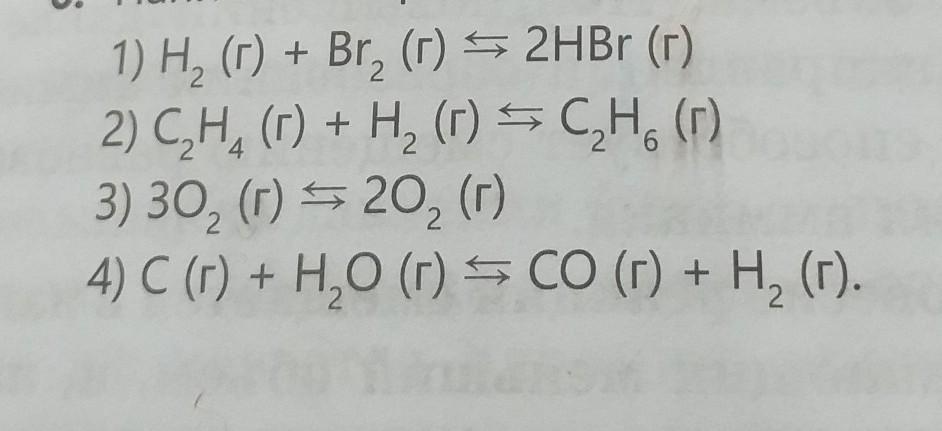
Ответы
Ответ:
Констант равновесия - это отношение концентраций продуктов реакций к произведению концентраций исходных веществ.
Например:
1) aA + bB ⇄ cC + dD - Уравнение реакций, следовательно мы получаем:
Kравн. =
2) aA + bB ⇄ cC - Уравнение реакций, следовательно мы получаем:
Kравн. =
3) Если aA ⇄ bB - Уравнение реакций, следовательно мы получаем:
Kравн. =
Констант равновесия зависит от: природы реагирующих веществ; температуры.
В константе равновесия учитывается только газообразные состояния, а не учитывается только твердое и жидкое состояние.
Теперь начинаем делать ваше задание:
1) H₂ (г) + Br₂ (г) ⇄ 2HBr (г) ⇒ Kравн = [HBr]²/[H₂]×[Br₂]
2) C₂H₄ (г) + H₂ (г) ⇄ C₂H₆ (г) ⇒ Kравн = [C₂H₆]/[C₂H₄]×[H₂]
3) 3O₂ (г) ⇄ 2O₂ (г) ⇒ Kравн = [O₂]²/[O₂]³
4) C (г) + H₂O (г) ⇄ CO (г) + H₂ (г) ⇒ Kравн = [CO₂]×[H₂]/[C]×[H₂O]
Решено от: DK954