СРОЧНОООО
задача по химии
Вычислите объём углекислого газа который выделится при взаимодействии 6,9 г карбоната калия с избытком соляной кислоты.
сфотала то, что сделала. дальше не понимаю. надеюсь вашу на помощь..
Приложения:
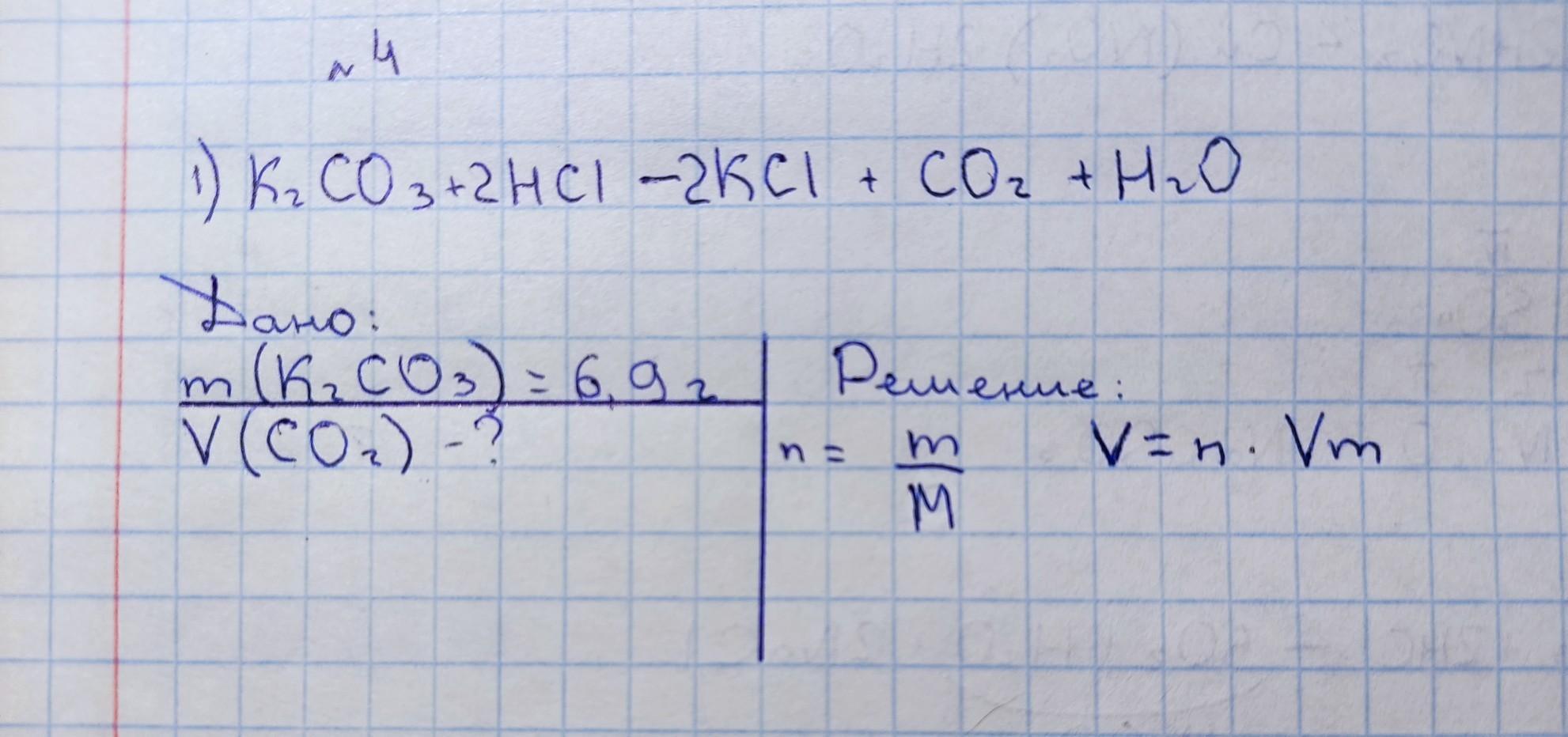
Ответы
Ответ дал:
1
Ответ: 1,12 л
Дано:
m(K2CO3) = 6,9 г
V(CO2)-?
Объяснение:
M(K2CO3) = 39*2+12+16*3 = 138 г/моль
n(K2CO3) = m(K2CO3)/V(K2CO3) = 6.9 г/138 г/моль = 0,05 моль
Vm = 22,4 л/моль
Составляем УХР:
K2CO3 + 2HCl = 2KCl + CO2 + H2O
Из УХР видно, что n(CO2)=n(K2CO3)
n(CO2) = 0.05 моль
Находим объём углекислого газа:
V(CO2) = n(CO2)*Vm = 0,05 моль*22,4 л/моль = 1,12 л
Ответ: 1,12 л
Вас заинтересует
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
8 лет назад
9 лет назад