20 г сульфатной кислоты вступает в реакцию с натрий гидроксидом. Какая соль и сколько ее по массе образуется?
нужно до 10.05.22
Ответы
Ответ дал:
2
Ответ:
В ходе реакции образовалась соль сульфат натрия (Na2SO4)
массой 28,4 г
Объяснение:
20 г сульфатной кислоты вступает в реакцию с натрий гидроксидом. Какая соль и сколько ее по массе образуется?
Дано:
m(H2SO4)=20г
Найти:
m(Na2SO4)
Молярная масса H2SO4:
M(H2SO4)=1×2+32+16×4=98 г/моль
Молярная масса Na2SO4:
M(Na2SO4)=23×2+32+16×4=142 г/моль
Решение
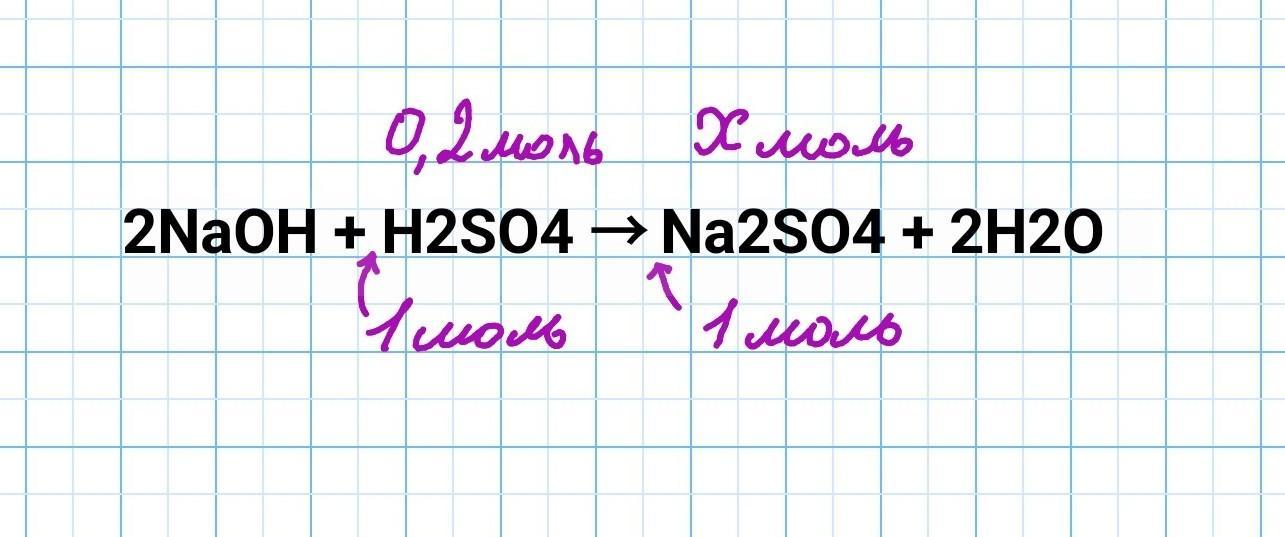
1) Составляем уравнение реакции
Образовавшаяся соль - Na2SO4 сульфат натрия.
2) Находим количество вещества H2SO4, вступившего в реакцию
моль
3) Составляем соотношение количеств веществ
моль
моль
4) Находим массу сульфата натрия
г
#SPJ1
Приложения:
15907532488:
Спасибо, у меня вышло тоже самое, хотела проверить, очень рада, что ответ совпал
Вас заинтересует
2 года назад
2 года назад
2 года назад
8 лет назад
9 лет назад