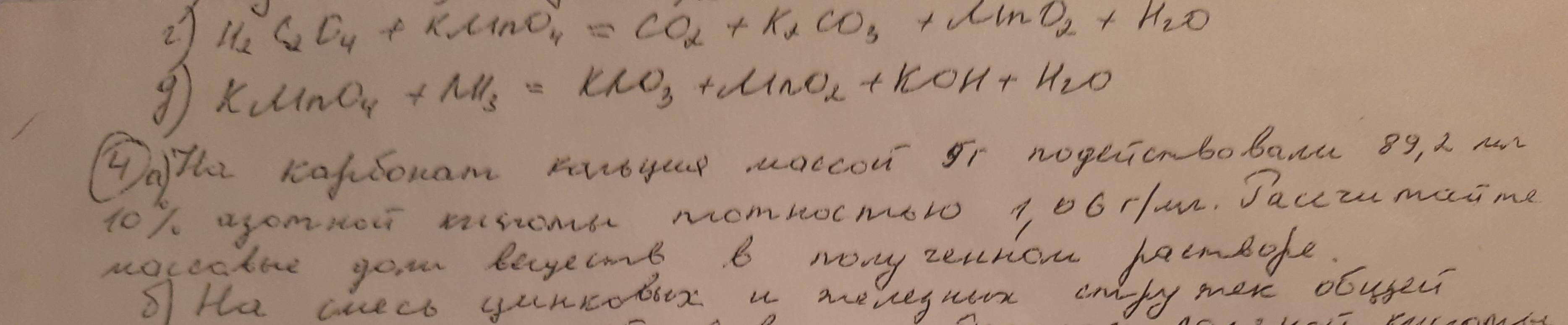Ответы
Найдем сколько грамм кислоты было.
89,2мл * 1,06г/мл ≈ 94,55г
Теперь найдем сколько кислоты было.
94,55г * 10% ≈ 9,46г
100%
CaCO3 + 2HNO3 --> Ca(NO3)2 + H2O + CO2↑
1 : 2 : 1 : 1 : 1
M(CaCO3)= 40 + 12 + 16*3 = 100г/моль
M(HNO3)= 1 + 14 + 16*3 = 63г/моль
n(CaCO3)= 9г / 100г/моль = 0,09 моль
n(HNO3)= 9,46г / 63г/моль ≈ 0,15 моль
0,15 моль / 2 = 0,075 моль
HNO3 по молям меньше, считаем через него.
M(Ca(NO3)2)= 40 + (14+16*3)*2= 164г/моль
m(Ca(NO3)2)= 164г/моль * 0,075 моль = 12,3г - столько новой соли получилось
m(CaCO3)= 0,075 моль * 100г/моль = 7,5г
9г-7,5г = 1,5г
M(CO2)= 44г/моль
m(CO2)= 44г/моль * 0,075 моль = 3,3г
Найдем новую массу раствора.
94,55г + 9г - 3,3г = 100,25г - новая масса раствора.
%(CaCO3)= 1,5г * 100% ≈ 1,5%
100,25г
%(HNO3)= 12,3г * 100% ≈ 12,27%
100,25г
Воды в растворе 100% - 1,5% - 12,27% = 86,23%