1. При электролизе 585 г расплава хлорида натрия выделилось 112 л хлора C
Сколько граммов натрия при этом образовалось?
Omeem: 230 r. Пожалуйста помогите
Ответы
Ответ дал:
6
Ответ:
2NaCl → 2Na + Cl₂↑ (эл.ток)
Молярная масса M(NaCl) = 23 + 35,5 = 58.5 г/моль
Количество вещества n=m/M = 585 г / 58,5 г/моль = 10 моль.
По уравнению реакции из 2 моль NaCl образуется 1 моль Cl₂, тогда из 10 моль NaCl получится 5 моль Cl₂.
Объем хлора V (Cl₂) = 5 моль * 22,4 л/моль = 112 л.
112 л - это 100%
100 л ------ x %; x = 100 л * 100% / 112 л = 89,29%
Выход 89,29%.
Объяснение:
вот,надеюсь помогла
Ответ дал:
11
Ответ:смотри вложение
Объяснение:
Приложения:

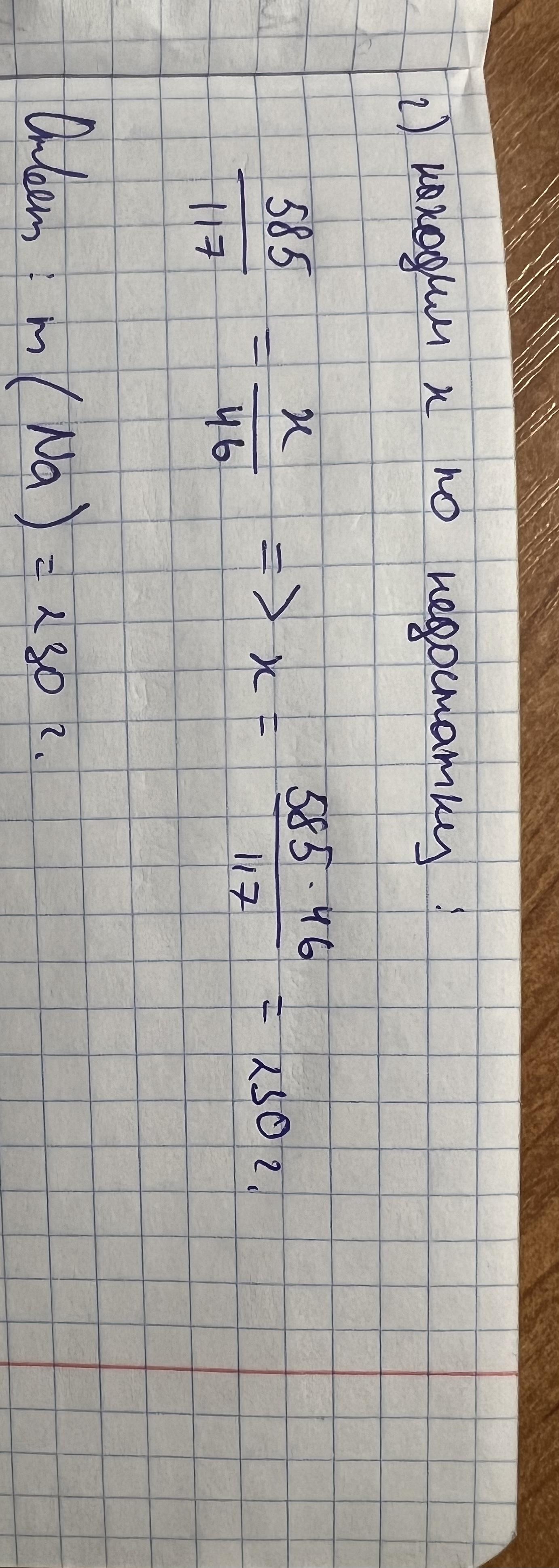
Вас заинтересует
1 год назад
1 год назад
1 год назад
1 год назад
3 года назад
3 года назад
8 лет назад