50 баллов
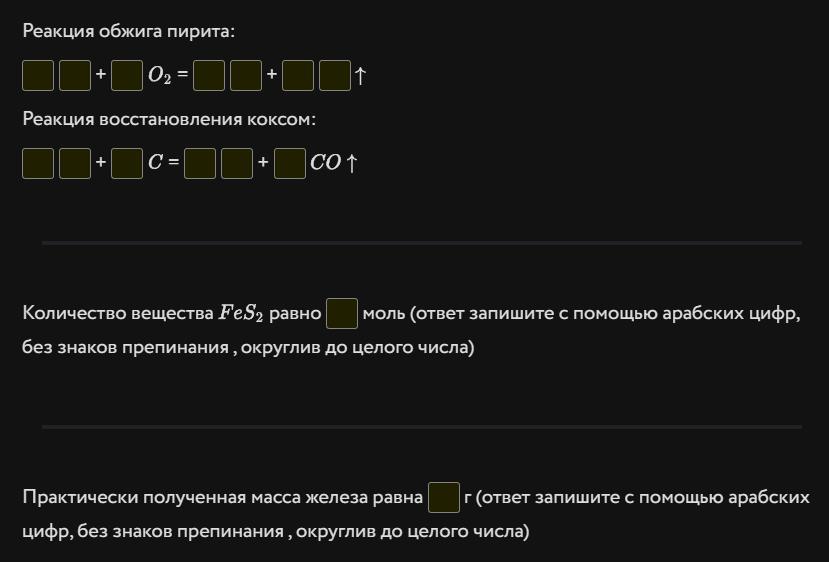
Образец пирита (основное вещество в руде — FeS2 ) массой 60 кг, содержащий основное вещество и 20 % инертных примесей, подвергли обжигу, затем железосодержащий продукт реакции восстановили коксом (C). Запишите уравнения указанных реакций. Какова масса железа, которую можно практически получить из этого образца руды, если считать что суммарный выход железа по обеим реакциям составляет 80 %? (в расчётах атомные массы химических элементов округлите до целых)
Приложения:
Ответы
Ответ дал:
1
Ответ:Перша реакція - обжиг пирита:
FeS2 + 3O2 → Fe2O3 + 2SO2
Утворилась суміш оксидів заліза та сірки. Далі залізо з реакції з коксом утворює металеве залізо:
Fe2O3 + 3C → 2Fe + 3CO
Загальне рівняння реакції:
2FeS2 + 7O2 + 6C → 2Fe + 2CO2 + 4SO2
З маси пирита (60 кг) і 20% інертних домішок, маса FeS2 у ньому буде:
m(FeS2) = 60 кг * (1 - 0.2) = 48 кг
Загальний вихід железа від обох реакцій складає 80%, тому маса заліза, яку можна отримати з 48 кг пириту, буде:
m(Fe) = 48 кг * 2 * (55.8 г/моль) / (2*120 г/моль) * 0.8 = 66.96 кг
Отже, можна отримати приблизно 67 кг заліза з 60 кг пириту.
Объяснение:
Вас заинтересует
1 год назад
1 год назад
1 год назад
1 год назад
3 года назад
3 года назад
8 лет назад
8 лет назад