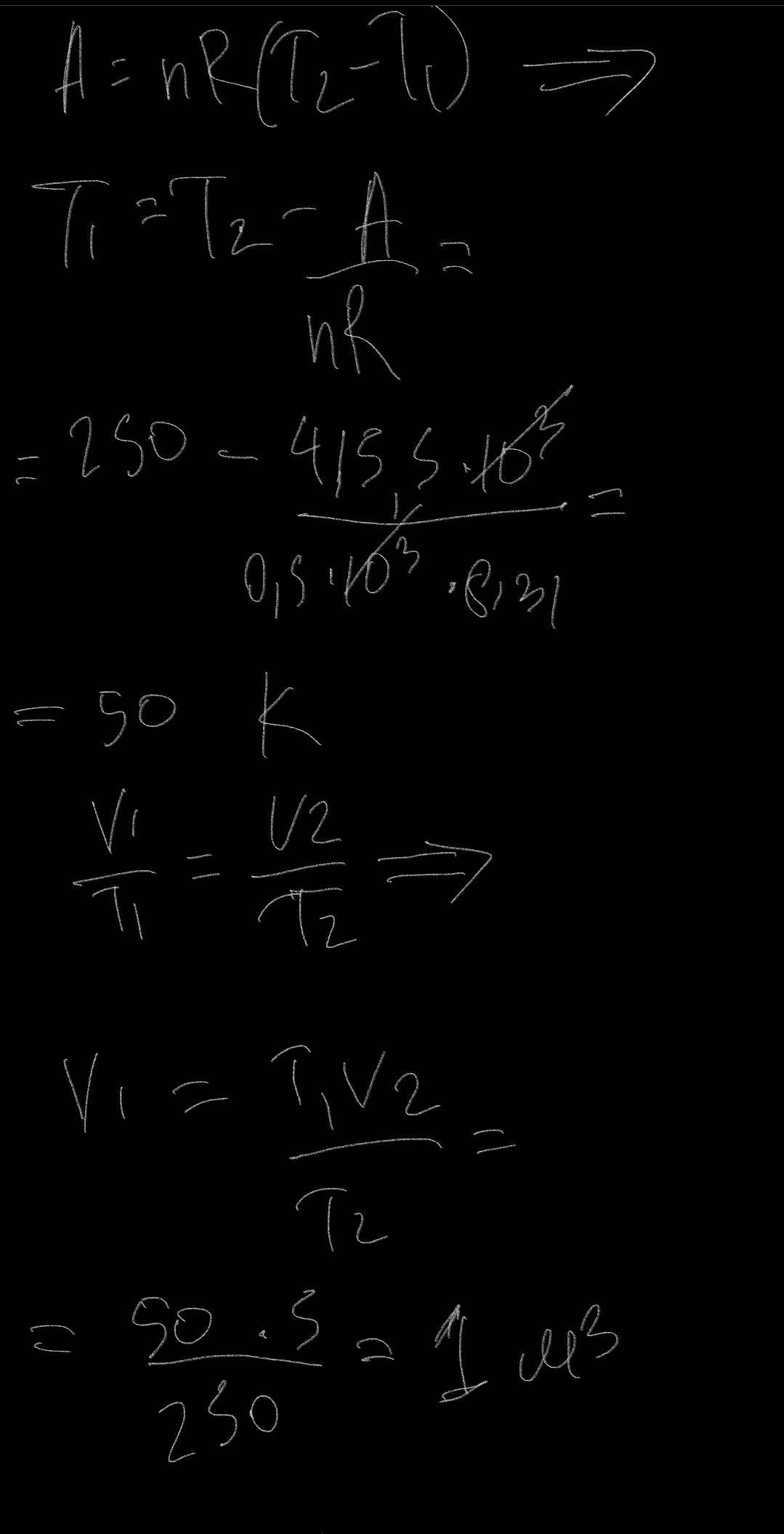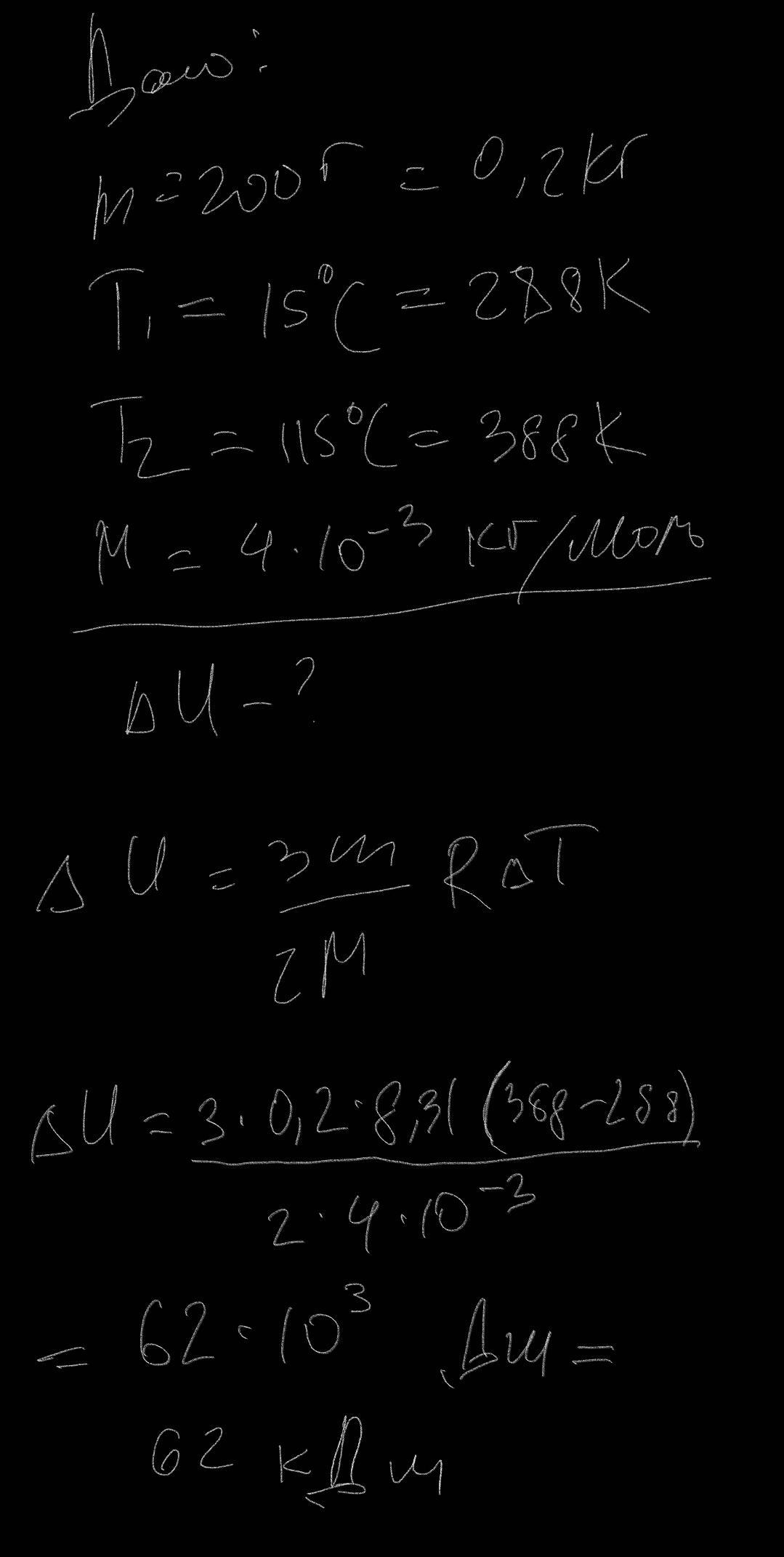№1 При ізобарному розширенні 0,5 кмоль ідеального газу отримав енергію, за рахунок якої було виконано роботу 415,5 кДж та встановлено температуру 250К і отримано об’єм газу 5 м3. Знайдіть температуру, тиск і об’єм газу в початковому стані.
№2 Гелій масою 200 г нагріли від 15 0С до 115 0С. Знайти зміну внутрішньої енергії
Дуже потрібноооо!!1 ПРОШУУУ
Ответы
Ответ:
Объяснение:
Для розв'язання задачі використаємо рівняння газової стану:
pV = nRT,
де p - тиск газу, V - об'єм газу, n - кількість речовини газу (в кількості кількість молекул, в даному випадку 0.5 кмоль), R - універсальна газова стала (8.31 Дж/(моль·К)), T - температура газу.
Для знаходження тиску і об'єму газу в початковому стані використовуємо рівняння газової стану для початкового стану (позначимо індексом 1):
p1V1 = nRT1
Аналогічно, для кінцевого стану (позначимо індексом 2):
p2V2 = nRT2
Так як розширення відбувається при ізобарному процесі, тиск залишається сталим. Тому можна записати:
p1V1 = p2V2 = nRT
Отже, в початковому та кінцевому станах кількість речовини, найважливіша для нашої задачі, залишається незмінною. Знайдемо спочатку тиск p, використовуючи дані про кінцевий стан:
p = nRT/V2 = (0.5 кмоль) * (8.31 Дж/(моль·К)) * (250 К) / (5 м³) = 207.75 Па
Тепер можемо знайти температуру в початковому стані:
T1 = p1V1/nR = p2V2/nR = (207.75 Па) * (5 м³) / (0.5 кмоль * 8.31 Дж/(моль·К)) = 498.8 К
Отже, температура в початковому стані дорівнює 498.8 К.
Тепер можемо знайти об'єм в початковому стані:
V1 = nRT1/p1 = (0.5 кмоль) * (8.31 Дж/(моль·К)) * (498.8 К) / (207.75 Па) = 6 м³
Отже, об'єм газу в початковому стані дорівнює 6 м³.
Ответ:
в фото
Объяснение: