Какой объем газа выделится (при н.у.) при растворении 320 г технического магния, содержащего 25% посторонних примесей, в соляной кислоте? Срочно 100 баллов !!!!!
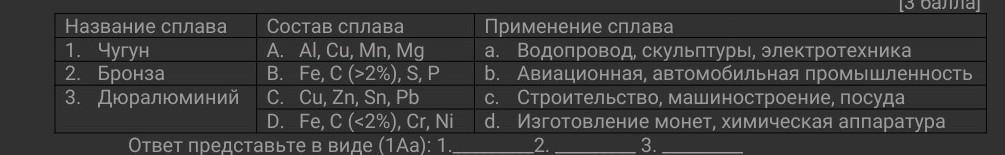
Ответы
Ответ:
Для решения этой задачи, сначала нужно определить массу чистого магния, исключив массу примесей. Поскольку примеси составляют 25%, чистый магний составит 75% от общей массы. Таким образом, масса чистого магния будет:
$$320 г \times 0.75 = 240 г$$
Магний реагирует с соляной кислотой с образованием хлорида магния и водорода по уравнению:
$$\text{Mg} + 2\text{HCl} \rightarrow \text{MgCl}_2 + \text{H}_2$$
Молярная масса магния (Mg) равна 24.305 г/моль, поэтому количество молей магния в 240 г будет:
$$\frac{240 г}{24.305 г/моль} \approx 9.87 молей$$
При нормальных условиях (н.у.), которые предполагают температуру 0°C и давление 1 атм, 1 моль газа занимает объем 22.4 литра. Следовательно, объем водорода, который выделится при реакции 9.87 молей магния, будет:
$$9.87 молей \times 22.4 л/моль \approx 221 литров$$
Таким образом, при реакции 320 г технического магния, содержащего 25% примесей, в соляной кислоте выделится примерно 221 литр водорода при нормальных условиях. Это теоретический расчет, и на практике объем может немного отличаться из-за различных факторов, таких как чистота реагентов и условия реакции.