Найти объем углекислого газа, который образуется при разложении 315 граммов карбоната магния, содержащего 20% примесей.
(С объяснением)
Ответы
Ответ дал:
0
гшнеу5квркукавмкуиве
Приложения:
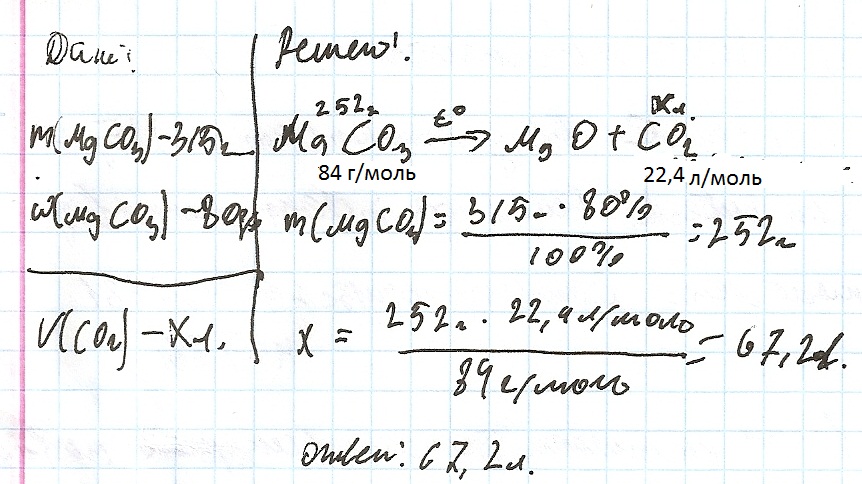
Ответ дал:
0
MgCO3 = MgO + CO2
находим массу чистого карбоната: 315*0,2= 63г
находим его хим. кол-во: 63/64= 0,984(моль)
по уравнению соотношение карбоната и углекислого газа 1;1, тогда и CO2 будет 0,984(моль)
находим объем СО2: 0,984*22,4= 22,05 дм3
находим массу чистого карбоната: 315*0,2= 63г
находим его хим. кол-во: 63/64= 0,984(моль)
по уравнению соотношение карбоната и углекислого газа 1;1, тогда и CO2 будет 0,984(моль)
находим объем СО2: 0,984*22,4= 22,05 дм3
Приложения:
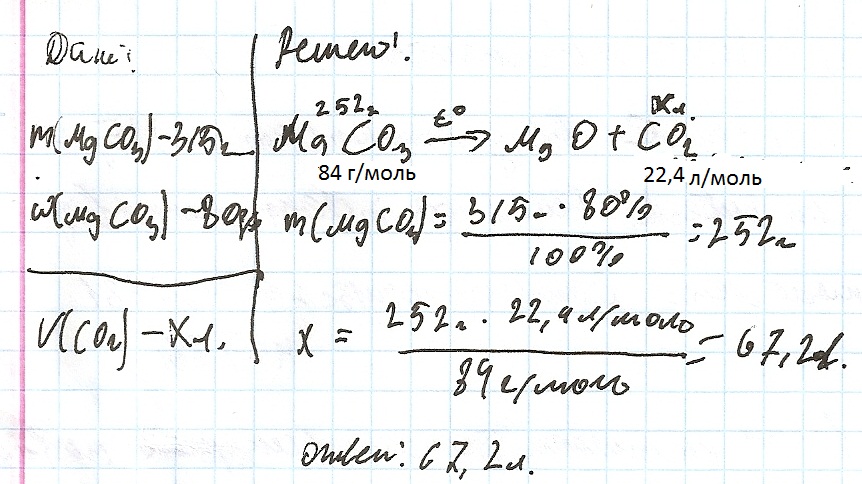
Вас заинтересует
2 года назад
2 года назад
8 лет назад
10 лет назад
10 лет назад
11 лет назад