СРОЧНО ПОМОГИТЕ!!!!25баллов!!!Термохимические реакции
Термохимическое уравнение реакции полного сгорания метана:
CH4(г) + 2O2(г) → CO2(г) + 2H2O(ж)
ΔH = –882 кДж/моль
Термохимическое уравнение реакции полного сгорания этана:
2C2H6(с) + 7O2(г) → 4CO2(г) + 6H2O(ж)
ΔH = –1560 кДж/моль
Молярная масса метана – 16 г/моль
Молярная масса этана – 30 г/моль
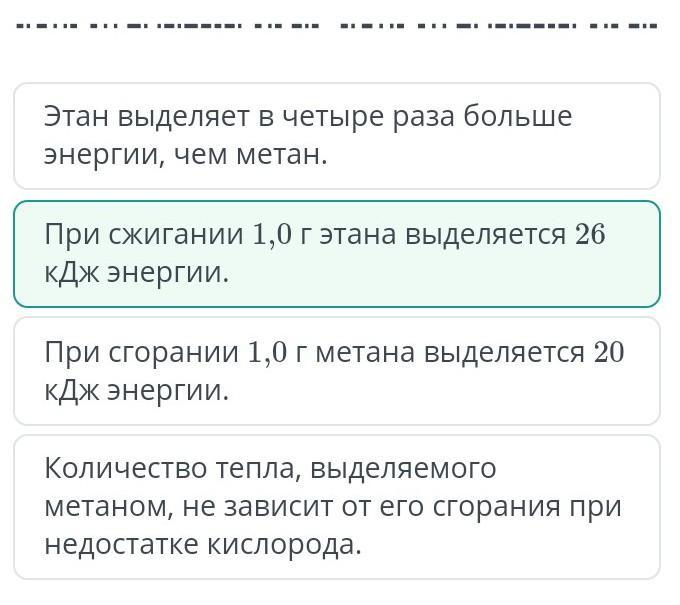
Выбери верное утверждение.
Количество тепла, выделяем
Приложения:

Ответы
Ответ дал:
23
Ответ:
при сжигании 1,0 г этана вылеляется 26 кДж энергии.)
Приложения:
madamdurian25:
спасибо ❤️
Вас заинтересует
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
9 лет назад