Задание на фото,правильный ответ галочкой и зеленым цветом подмечен. Хочу решение понять. пожалуйста
Приложения:
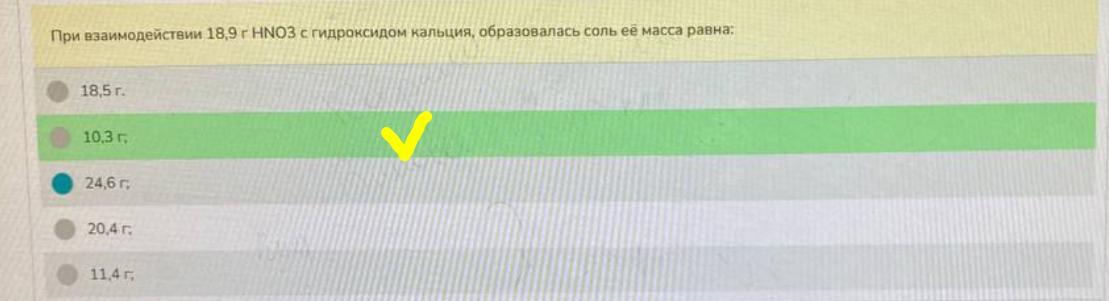
andrdys:
есть какие то версии свои? Составляется уравнение и через мольное соотношение веществ находят массу
да я так попытался решить, вышло 24.6 но ответ 10.3
сейчас попробую тоже
из 18.9 г кислоты не может получится соли меньшей массы, так как нарушается закон сохранения массы.
и я об этом
Ответы
Ответ дал:
1
Ответ:
Сa(OH)₂ + 2HNO₃ = Ca(NO₃)₂ + 2H₂O
n(HNO₃) = m/M = 18,9г/ 63г/моль = 0,3 моль
n(Ca(NO₃)₂ ) = n(HNO₃)/2 = 0,3моль/2 = 0,15моль
m(Ca(NO₃)₂ ) = n(Ca(NO₃)₂ ) * M(Ca(NO₃)₂ )
m(Ca(NO₃)₂ ) = 0,15моль * 164г/моль
m(Ca(NO₃)₂ ) = 24,6г
Объяснение:
из 18.9 г кислоты не может получится соли меньшей массы (10,3 )так как нарушается закон сохранения массы. Так что ответ в тесте противоречит логике
Я также решал, но сайт отвечает что неверно. возможно ошибка на сайте ведь он часто гонит с ответами
я уверен что ошибка либо в ответе или в условии. 10,3 получается при 7,9г кислоты
Вас заинтересует
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
9 лет назад