Помогите, очень срочно!!!
1. Наважку калій дихромату (K2Cr2O7) зважуємо на аналітичних терезах.
m (K2Cr2O7) = 0.4679 г.
2. Об’єм розчину натрій тіосульфату, витрачений на титрування, см3 - V1 (9.2); V2( 9.3); V3( 9.2); Vсереднє -?
Задача № 2. Приготування 100мл 0.1н розчину К2Сr2О7.
1. Розрахунок маси наважки калій дихромату:
Дано:
Vр= 100 мл
N = 0,1г-екв/л
m (К2Сr2О7) = ?
2. Розрахувати грам-еквівалент калій дихромату:
3. Реакція проходить по схемі:
K2Cr2O7 + 6 KI + 7 H2SO4 = Cr2(SO4)3 + 3 I2 + 4 K2SO4 + 7 H2O
Cr2+6 +6e → Cr2+3 │6 │ │ 1
2 I− – 2e → I20 │2 │6 │ 3
Е(К2Сr2О7) = (М(К2Сr2О7))/6 = 49 г-екв/моль
4. Розрахувати масу калій дихромату:
Відповідь: m (Na2S2O3 ∙ 5 H2O) = ____________ г.
5. Наважку калій дихромату (K2Cr2O7) зважуємо на аналітичних терезах.
m (K2Cr2O7) = ____________ г.
Наважку переносять у мірну колбу на 100 мл, розчиняють у дистильованій воді і доводять об’єм водою до мітки.
Переливають у склянку для зберігання розчину. Наносять маркування на склянку (концентрація речовини, дата, виконавець), зберігають у спеціально відведеному місці.
6. Проводимо розрахунки:
7. Знаходимо титр розчину.
Т (K2Cr2O7) =
8. Знаходимо нормальність розчичину.
N (K2Cr2O7) =
9. Знаходимо молярність розчину.
М (K2Cr2O7) =
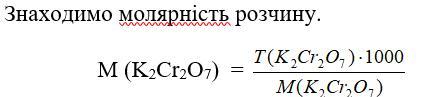
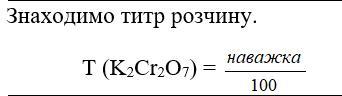
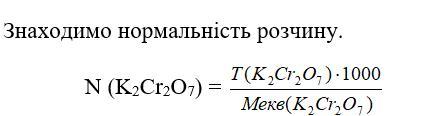
Ответы
Задача № 1:
Для рассчета массы натрия тиосульфата необходимо узнать его молярную массу. Натрий тиосульфат пятиводный (Na2S2O3 ∙ 5 H2O), поэтому для расчета молярной массы нужно учитывать молекулярную массу самого соединения и пять молекул воды.
Молярная масса Na2S2O3 ∙ 5 H2O = (2 * М(Na)) + М(S) + (2 * М(O)) + (5 * [(2 * М(H)) + М(O)]) = 2 * 23 + 32 + 2 * 16 + 5 * (2 * 1 + 16) = 248 г/моль
Грам-эквивалент натрия тиосульфата равен его молярной массе, так как каждая молекула тиосульфата отдаёт два эквивалента электронов.
Е(Na2S2O3 ∙ 5 H2O) = 248 г-экв/моль
Рассчитаем массу натрия тиосульфата, необходимую для приготовления 100 мл 0,1 н раствора.
m (Na2S2O3 ∙ 5 H2O) = (Vр * N * Е(Na2S2O3 ∙ 5 H2O)) / 1000 = (100 * 0,1 * 248) / 1000 = 2,48 г
Ответ: m (Na2S2O3 ∙ 5 H2O) = 2,48 г
Взвешиваем 2,48 грамма натрия тиосульфата на аналитических весах.
Переносим вес в мерную колбу на 100 мл, растворяем в дистиллированной воде и доводим объем до метки.
Переливаем в стеклянку для хранения раствора и наносим маркировку на стеклянку (концентрация вещества, дата, исполнитель). Храним в специально отведенном месте.